题目内容
3.四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是( )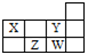
| A. | 1个37W原子中,质子数比中子数多3个 | |
| B. | Y和W处于同一主族,具有相同的最高价态 | |
| C. | Z形成简单阴离子半径小于W形成简单阴离子半径 | |
| D. | X与Y、Z与W每组两种元素间均可形成电子数相等的氢化物 |
分析 X、Y、Z、W都是短周期元素,根据在元素周期表位置可知,X是N元素、Y是F元素、Z是S元素、W是Cl元素,由此分析解答.
解答 解:A、1个37Cl原子中,质子数是17,中子数不37-17=20,所以质子数比中子数少3个,故A错误;
B、氟只有负价和0价,而氯的最高价为+7价,故B错误;
C、硫离子和氯离子具有相同的电子层结构,质子数越多半径越小,所以Z形成简单阴离子半径大于W形成简单阴离子半径,故C错误;
D、氨气和氟化氢是10电子,而硫化氢和氯化氢是18电子,所以X与Y、Z与W每组两种元素间均可形成电子数相等的氢化物,故D正确;
故选D.
点评 本题考查元素周期表和周期律的综合应用,难度不大,注意氟的化合价,无正价.

练习册系列答案
相关题目
13.由乙烯推测丙烯(CH3CH=CH2)的结构或性质正确的是( )
| A. | 分子中3个碳原子在同一直线上 | B. | 分子中所有原子在同一平面上 | ||
| C. | 与氯化氢加成只生成一种产物 | D. | 能发生加聚反应 |
14.现有部分短周期元素的性质或原子结构如下表:
(1)元素T的阴离子的结构示意图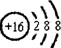 ;元素X的最高价氧化物的电子式
;元素X的最高价氧化物的电子式
(2)元素Y 在周期表中位于二周期,ⅤA族.该元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(3)四种元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式)
(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bce
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.Z的最高价氧化物所对应的水化物比T的最高价氧化物所对应的水化物的酸性强
d.Z的氢化物比T的氢化物溶解度大
e.Z的单质与H2化合比 T的单质与H2化合更容易
(5)含有34个电子的元素X的氢化物的分子式C4H10
(6)写出实验室制备Z单质的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(7)比较T和Z的简单离子的半径大小:S2->Cl-(用元素离子符号表示)
| 元素编号 | 元素性质或原子结构 |
| T | M层的电子数为K层电子数的3倍 |
| X | 其氢化物的空间构型为正四面体 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
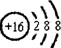 ;元素X的最高价氧化物的电子式
;元素X的最高价氧化物的电子式
(2)元素Y 在周期表中位于二周期,ⅤA族.该元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(3)四种元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式)
(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bce
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.Z的最高价氧化物所对应的水化物比T的最高价氧化物所对应的水化物的酸性强
d.Z的氢化物比T的氢化物溶解度大
e.Z的单质与H2化合比 T的单质与H2化合更容易
(5)含有34个电子的元素X的氢化物的分子式C4H10
(6)写出实验室制备Z单质的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(7)比较T和Z的简单离子的半径大小:S2->Cl-(用元素离子符号表示)
15.用NA表示阿伏伽德罗常数的值,下列叙述中不正确的是( )
| A. | 分子总数为NA的NO2和CO2的混合气体中含有的氧原子数是2NA | |
| B. | 28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 常温常压下,22.4L氯气与足量镁粉充分反应后,转移的电子数为2NA |
13.月季花适宜在酸性土壤中生长.某同学给月季花施肥前,对下列氮肥溶液的pH进行了测定,结果如下:
该同学最好选用( )
| 化肥名称 | 尿素 | 碳酸氢铵 | 硫酸铵 | 氨水 |
| 溶液的pH | 7 | 8 | 5 | 11 |
| A. | 碳酸氢铵 | B. | 尿素 | C. | 氨水 | D. | 硫酸铵 |
 元素及其化合物的学习和应用是中学化学的主要任务之一.
元素及其化合物的学习和应用是中学化学的主要任务之一.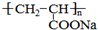 )是一种强吸水树脂.由某烃A合成聚丙烯酸钠的流程如图:
)是一种强吸水树脂.由某烃A合成聚丙烯酸钠的流程如图: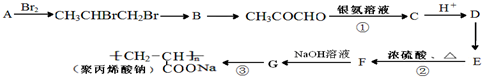
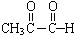 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$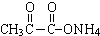 +3NH3+2Ag↓+H2O.
+3NH3+2Ag↓+H2O.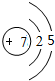 .
.