题目内容
2.若溶液中由水电离产生的c(OH-)=1×10-14 mol•L-1,满足此条件的溶液中一定可以大量共存的离子组是( )| A. | CH3COO- Na+ NO3- Cl- | B. | K+ Na+ Cl- NO3- | ||
| C. | K+ Na+ Cl- AlO2- | D. | K+ I- SO42- NO3- |
分析 溶液中由水电离产生的c(OH-)=1×10-14 mol•L-1,为酸或碱溶液,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:溶液中由水电离产生的c(OH-)=1×10-14 mol•L-1,为酸或碱溶液,
A.酸溶液中不能大量存在CH3COO-,故A不选;
B.酸、碱溶液中该组离子之间不反应,可大量共存,故B选;
C.酸溶液中不能大量存在AlO2-,故C不选;
D.酸溶液中H+、I-、NO3-发生氧化还原反应,不能大量共存,故D不选;
故选B.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
13.下列图象中的曲线正确的是( )
| A. | 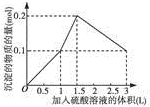 图A表示在1L含0.1mol NaAlO2和0.1mol Ba(OH)2的混合溶液中,逐滴加入浓度为0.11mol•L-1H2SO4溶液,产生沉淀的物质的量与加入硫酸溶液体积的图象 | |
| B. | 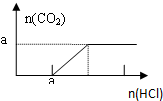 图B表示在分别含amol的Na2CO3和NaOH的混合溶液中逐滴滴加稀盐酸,产生气体 与加入盐酸体积的图象 | |
| C. | 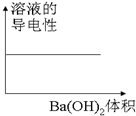 图C表示向100mL 0.1mol/L H2SO4溶液中,逐滴加入0.1mol/L Ba(OH)2溶液至过量, 溶液的导电性与加入 Ba(OH)2溶液体积的图象 | |
| D. | 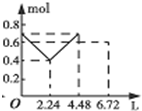 图D表示在往含0.2mol NaOH和0.1mol Ba(OH)2的溶液中持续稳定地通入CO2气体, 溶液中离子数目和通入CO2气体体积的图象(气体的溶解忽略不计) |
10.元素X原子的最外层有1个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物( )
| A. | 只能是离子化合物X2Y | |
| B. | 只能是共价化合物X2Y2 | |
| C. | 既可能是离子化合物也可能是共价化合物 | |
| D. | 形成的化合物无论是X2Y还是X2Y2 原子都达到了8电子稳定结构 |
7.pH相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌已全部溶解且放出气体一样多,为此下列说法正确的是( )
| A. | 反应结束后溶液的pH:甲>乙 | |
| B. | 反应开始时的速率:甲>乙 | |
| C. | 反应所需时间:甲<乙 | |
| D. | 反应开始时,酸的物质的量浓度:甲>乙 |
14.下列关于晶体的说法正确的是( )
| A. | 熔化二氧化硅和金刚石时所克服的粒子间的作用力类型同种 | |
| B. | 原子晶体的熔点一定比金属的高 | |
| C. | 构成分子晶体的微粒一定含有共价键 | |
| D. | 晶体中只要有阳离子就一定有阴离子 |
4.相同物质的量的 Na+、OH-、F- 离子具有相同的( )
| A. | 质量 | B. | 质子数 | C. | 电子数 | D. | 中子数 |
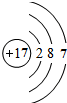 ,NH4Cl的电子式
,NH4Cl的电子式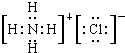 ;
;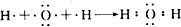 ;
; 化学反应与能量有着密不可分的关系,回答下列问题.
化学反应与能量有着密不可分的关系,回答下列问题.