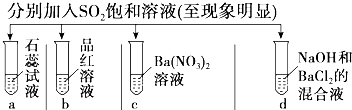
题目内容
4.相同物质的量的 Na+、OH-、F- 离子具有相同的( )| A. | 质量 | B. | 质子数 | C. | 电子数 | D. | 中子数 |
分析 原子:电子数=质子数,阳离子:电子数=质子数-电荷数,阴离子:电子数=质子数+电荷数,中子数=质量数-质子数,据此分析.
解答 解:Na+的质量数为23,质子数为11,电子数为10;
OH-的质量数为17,质子数为9,电子数为10;
F- 的质量数为19,质子数为9,电子数为10;
综上可知,相同物质的量的 Na+、OH-、F- 离子具有相同电子数;
故选C.
点评 本题考查了原子的构成,明确原子、离子中微粒之间的关系即可解答,题目难度不大.

练习册系列答案
相关题目
2.若溶液中由水电离产生的c(OH-)=1×10-14 mol•L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
| A. | CH3COO- Na+ NO3- Cl- | B. | K+ Na+ Cl- NO3- | ||
| C. | K+ Na+ Cl- AlO2- | D. | K+ I- SO42- NO3- |
3.把a L含碳酸铵、氯化铵的溶液分成两等份,一份需用b mol烧碱刚好把氨全部赶出,另一份与氯化钡溶液反应时,消耗c mol氯化钡,由此可知原溶液中Cl-的物质的量浓度是(单位:mol•L-1)( )
| A. | $\frac{b-2c}{a}$ | B. | $\frac{b-2c}{2a}$ | C. | $\frac{2b-c}{a}$ | D. | $\frac{2b-4c}{a}$ |
16.已知100℃时,水的离子积常数为1×10-12.100℃时0.1mol•L-1的HX溶液中,$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-6,在该条件下对0.1mol•L-1的HX溶液,下列说法中正确的是( )
| A. | HX的电离方程式为:HX=H++X- | |
| B. | 该溶液中c(HX)>c (H+)>c (X-)>c (OH-) | |
| C. | 此溶液的pH=1 | |
| D. | NaX与HX的混合溶液pH=6时,溶液显酸性 |
13.25℃时,KNO3在水中的饱和溶液物质的量浓度是6mol•L-1,若将1mol固体KNO3置于1L水中,则KNO3变成盐溶液过程的△H-T△S的取值为( )
| A. | 小于0 | B. | 等于0 | C. | 大于0 | D. | 不能确定 |
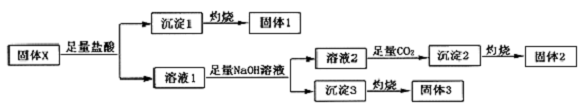
 ,沉淀2的化学式为Al(OH)3.
,沉淀2的化学式为Al(OH)3.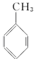 B.
B.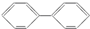 C.
C. D.
D.
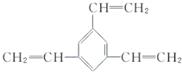 与溴的四氯化碳溶液反应的化学反应方程式为
与溴的四氯化碳溶液反应的化学反应方程式为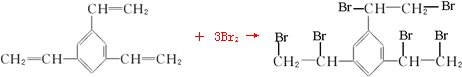 .
. .
.