题目内容
13.下列图象中的曲线正确的是( )| A. | 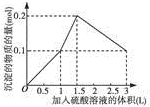 图A表示在1L含0.1mol NaAlO2和0.1mol Ba(OH)2的混合溶液中,逐滴加入浓度为0.11mol•L-1H2SO4溶液,产生沉淀的物质的量与加入硫酸溶液体积的图象 | |
| B. | 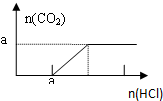 图B表示在分别含amol的Na2CO3和NaOH的混合溶液中逐滴滴加稀盐酸,产生气体 与加入盐酸体积的图象 | |
| C. | 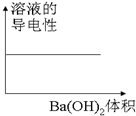 图C表示向100mL 0.1mol/L H2SO4溶液中,逐滴加入0.1mol/L Ba(OH)2溶液至过量, 溶液的导电性与加入 Ba(OH)2溶液体积的图象 | |
| D. | 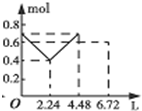 图D表示在往含0.2mol NaOH和0.1mol Ba(OH)2的溶液中持续稳定地通入CO2气体, 溶液中离子数目和通入CO2气体体积的图象(气体的溶解忽略不计) |
分析 A.在1L含0.1mol NaAlO2和0.1mol Ba(OH)2的混合溶液中,n(NaAlO2)=0.1mol,n[Ba(OH)2]=0.1mol,向该混合溶液中加入H2SO4溶液,首先发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O,Ba(OH)2反应完毕,继续加入H2SO4溶液,再发生反应AlO2-+H++H2O=Al(OH)3↓,AlO2-反应完毕,沉淀达最大,继续加入H2SO4溶液,发生反应Al(OH)3+3H+=Al3++3H2O,沉淀减少,Al(OH)3反应完毕,最后为BaSO4沉淀,继续加入H2SO4溶液,沉淀的量不变,据此进行判断;
B.对NaOH和Na2CO3混合配成的溶液,当滴加盐酸时,先发生氢氧化钠与盐酸的中和反应,再发生碳酸钠与盐酸的反应生成碳酸氢钠和氯化钠,最后发生碳酸氢钠与盐酸反应才有二氧化碳气体生成,利用物质的量的关系并结合图象即可解答;
C.硫酸没有完全反应前,随着氢氧化钡溶液的加入,溶液导电性会逐渐减弱,直至硫酸完全反应,氢氧化钡过量后溶液导电性又开始增强;
D.n(CO2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,通入含有0.2mol氢氧化钠和0.1mol氢氧化钡的溶液中,发生:2OH-+CO2=CO32-+H2O,CO32-+H2O+CO2=2HCO3-,Ba2++CO32-=BaCO3↓,以此解答该题.
解答 解:A.在1L含0.1mol NaAlO2和0.1mol Ba(OH)2的混合溶液中,n(NaAlO2)=0.1mol,n[Ba(OH)2]=0.1mol,向该混合溶液中加入H2SO4溶液,首先发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O,Ba(OH)2反应完毕,继续加入H2SO4溶液,再发生反应AlO2-+H++H2O=Al(OH)3↓,AlO2-反应完毕,沉淀达最大,继续加入H2SO4溶液,发生反应Al(OH)3+3H+=Al3++3H2O,沉淀减少,Al(OH)3反应完毕,最后为BaSO4沉淀,继续加入H2SO4溶液,沉淀的量不变.
第一阶段:由发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O可知,Ba(OH)2反应完毕,需加入0.1molH2SO4,H2SO4溶液的体积为:$\frac{0.1mol}{0.1mol/L}$=1L,生成沉淀n(BaSO4)=0.1mol;
第二阶段:由发生反应AlO2-+H++H2O=Al(OH)3↓可知,0.1molAlO2-反应完毕,该阶段需加入0.05molH2SO4,H2SO4溶液的体积为:$\frac{0.05mol}{0.1mol/L}$=0.5L,该阶段生成沉淀n[Al(OH)3]=0.1mol,但加入相同体积的硫酸,该阶段比第一阶段生成沉淀的多,为第一阶段的2倍;
第三阶段:由发生反应Al(OH)3+3H+=Al3++3H2O可知,沉淀减少,0.1molAl(OH)3完全溶解,该阶段需加入:$\frac{0.1mol×3}{2}$=0.15molH2SO4,H2SO4溶液的体积为:$\frac{0.15mol}{0.1mol/L}$=1.5L,沉淀n(BaSO4)=0.1mol,
由上述分析可知:第一阶段产生沉淀n(BaSO4)=0.1mol,加入H2SO4溶液的体积为1L;
第二阶段又生成沉淀n[Al(OH)3]=0.1mol,此时沉淀总量为0.2mol,该阶段加入H2SO4溶液的体积为0.1L,此时加入H2SO4溶液的总体积为1.5L;
第三阶段0.1molAl(OH)3完全溶解,此时沉淀n(BaSO4)=0.1mol,该阶段加入H2SO4溶液的体积为1.5L,此时加入H2SO4的总体积为3L.
故沉淀的量与H2SO4溶液体积关系图为: ,故A正确;
,故A正确;
B.向NaOH和Na2CO3混合溶液中滴加盐酸时,首先和NaOH反应生成水和氯化钠,即消耗amolHCl,两者恰好反应完全,无气体生成;
继续滴加时,盐酸和Na2CO3开始反应,消耗amolHCl发生HCl+Na2CO3=NaHCO3+NaCl,不放出气体,此步反应进行完全;当再加入amolHCl,发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑,正确的图象为: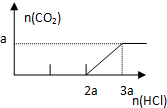 ,故B错误;
,故B错误;
C.发生反应为:Ba(OH)2+H2SO4=BaSO4↓+2H2O,滴入氢氧化钡时,导电性会减弱,完全反应后,氢氧化钡过量,导电性又增强,所以溶液导电性不会始终不变,故C错误;
D.n(CO2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,含有0.2mol氢氧化钠和0.1mol氢氧化钡的溶液中:n(OH-)=0.2mol+0.1mol×2=0.4mol,n(Na+)=0.2mol,n(Ba2+)=0.1mol,
通入CO2,发生反应为:2OH-+CO2=CO32-+H2O,OH-+CO2=HCO3-+H2O,Ba2++CO32-=BaCO3↓,
设生成xmolCO32-,ymolHCO3-,
则:2x+y=0.4、x+y=0.3,解得:x=0.1,y=0.2,
所以反应后溶液中含有:n(Na+)=0.2mol,n(HCO3-)=0.2mol,
可依次发生:①2OH-+CO2=CO32-+H2O,②Ba2++CO32-=CaCO3↓,离子浓度迅速减小,③CO32-+H2O+CO2=2HCO3-,所以正确的图象为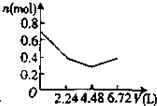 ,故D错误;
,故D错误;
故选A.
点评 本题考查了物质的量或浓度岁时间变化的曲线、溶液导电性与离子浓度关系等,题目难度较大,试题知识点较多、计算量较大,充分考查了学生的分析、理解能力及化学计算能力.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案| A. | 放热183 kJ | B. | 放热91.5 kJ | C. | 吸热183 kJ | D. | 吸热91.5 kJ |
| A. | Ca(ClO)2溶液中通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | |
| B. | 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入装有足量氯化钡溶液的洗气瓶中(如图装置),洗气瓶中产生的沉淀是硫酸钡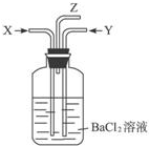 | |
| C. | 向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2 | |
| D. | 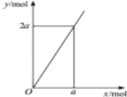 锌与不同浓度的硝酸可发生不同的反应(如图:y表示耗去Zn的物质的量,x表示被还原的硝酸的物质的量),4Zn+10HNO3(极稀)=4Zn(NO3)2+5H2O+N2O↑符合图示 |
| A. | 引进电动汽车,减少汽车尾气排放 | |
| B. | 大力发展火电,缓解用电紧张 | |
| C. | 开发太阳能、风能、氢能等清洁能源 | |
| D. | 积极推行和使用能被微生物降解的新型聚合物材料 |
| A. | 第n周期的最后一种金属元素处在第n-1族(1<n<7,n为正整数) | |
| B. | m=1和m=7(m为最外层电子数)的元素单质能形成的化合物都是离子化合物 | |
| C. | m-n=5(m为最外层电子数,n为电子层数)的主族元素存在最强的对应含氧酸 | |
| D. | 第n周期有n种主族金属元素(1<n<7,n为正整数) |
| A. | 燃烧反应都是放热反应 | |
| B. | 对于可逆反应:aA(g)+bB(g)?bC(g)+dD(g),如果正反应放热,逆反应一定吸热 | |
| C. | 氢气燃烧生成水是一个放热的化学反应,说明1 mol H2的能量高于1 mol H2O的能量 | |
| D. | 只有放热的氧化还原反应才可以设计为原电池 |
| A. | 酸和碱发生中和反应时放出的热量不一定是57.3KJ | |
| B. | 酸和碱发生中和反应时所放出的热量就叫中和热 | |
| C. | 在稀溶液中,酸跟碱发生中和反应生成1mol水时所放出的热量称为中和热 | |
| D. | 中和热不包括物质溶解、电离、水合等过程中的热效应 |
| A. | CH3COO- Na+ NO3- Cl- | B. | K+ Na+ Cl- NO3- | ||
| C. | K+ Na+ Cl- AlO2- | D. | K+ I- SO42- NO3- |
| A. | $\frac{b-2c}{a}$ | B. | $\frac{b-2c}{2a}$ | C. | $\frac{2b-c}{a}$ | D. | $\frac{2b-4c}{a}$ |