题目内容
17.(1)写出氯原子的原子结构示意图 ,NH4Cl的电子式
,NH4Cl的电子式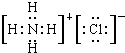 ;
;(2)用电子式表示H2O的形成过程
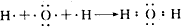 ;
;(3)已知一定条件下,白磷转化为红磷释放出能量,则等质量的白磷比红磷具有的能量高(填“高”、“低”),故白磷比红磷稳定性弱(填“强”、“弱”),等质量的白磷和红磷充分燃烧均生成五氧化二磷,白磷放出热量多.
分析 (1)氯原子的核电荷数=核外电子总数=17,最外层为7个电子;氯化铵属于离子化合物,铵根离子和氯离子都需要标出所带电荷及最外层电子;
(2)水分子为共价化合物,其分子中存在两个氧氢键,据此写出用电子式表示H2O的形成过程;
(3)放热反应中,反应物总能量大于生成物总能量,则白磷能量高;物质的能量越高,该物质越不稳定;生成物相同时,反应物总能量越高,则反应中放热热量越高.
解答 解:(1)氯原子的原子序数为17,其原子核外有3个电子层,各层容纳电子数分别为2、8、7,氯原子结构示意图为: ;
;
氯化铵为离子化合物,阴阳离子都需要标出所带电荷及最外层电子,氯化铵的电子式为: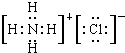 ,
,
故答案为: ;
;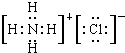 ;
;
(2)氢原子和氧原子之间以共用电子对而形成水分子,用电子式表示形成过程为: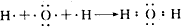 ,
,
故答案为: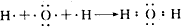 ;
;
(3)已知一定条件下,白磷转化为红磷释放出能量,说明反应物能量大于生成物总能量,则等质量的白磷比红磷具有的能量高,能量越高的物质越不稳定,故白磷比红磷稳定性弱;等质量的白磷和红磷充分燃烧均生成五氧化二磷,由于白磷能量高,属于白磷放出热量多,
故答案为:高;弱;白磷.
点评 本题考查了电子式的表示方法及其应用、化学反应与能量变化等知识,题目难度中等,注意掌握电子式的能够及书写原则,明确化学反应与能量变化的关系及物质稳定性与能量大小的关系.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
8.下列推断符合实际的是( )
| A. | 第n周期的最后一种金属元素处在第n-1族(1<n<7,n为正整数) | |
| B. | m=1和m=7(m为最外层电子数)的元素单质能形成的化合物都是离子化合物 | |
| C. | m-n=5(m为最外层电子数,n为电子层数)的主族元素存在最强的对应含氧酸 | |
| D. | 第n周期有n种主族金属元素(1<n<7,n为正整数) |
5.下列关于中和热的说法不正确的是( )
| A. | 酸和碱发生中和反应时放出的热量不一定是57.3KJ | |
| B. | 酸和碱发生中和反应时所放出的热量就叫中和热 | |
| C. | 在稀溶液中,酸跟碱发生中和反应生成1mol水时所放出的热量称为中和热 | |
| D. | 中和热不包括物质溶解、电离、水合等过程中的热效应 |
12.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法不正确的是( )


| A. | 元素的非金属性:Y>W | |
| B. | 阴离子的还原性:W2->Q- | |
| C. | 离子半径:Y2->Z3+ | |
| D. | Q、W、Y对应的氢化物的沸点逐渐降低 |
2.若溶液中由水电离产生的c(OH-)=1×10-14 mol•L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
| A. | CH3COO- Na+ NO3- Cl- | B. | K+ Na+ Cl- NO3- | ||
| C. | K+ Na+ Cl- AlO2- | D. | K+ I- SO42- NO3- |
9.已知某酸H2B在水溶液中存在下列关系:①H2B?H++HB-,②HB-?H++B2-.关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )
| A. | NaHB属于弱电解质 | |
| B. | 溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-) | |
| C. | NaHB和NaOH溶液反应的离子方程式为H++OH-═H2O | |
| D. | c(Na+)=c(HB-)+c(B2-)+c(H2B) |
6.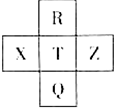 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:X<T<Q | B. | R与Q的电子数相差26 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | 简单离子的还原性:T>Q |
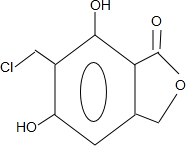 (任写一种).
(任写一种).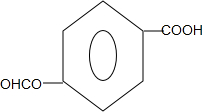 .
.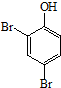 、HCHO为原料制备
、HCHO为原料制备 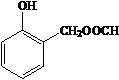 合成路线流程图(无机试剂任用).合成路线流程图示例如下:
合成路线流程图(无机试剂任用).合成路线流程图示例如下: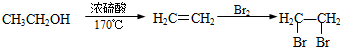
 B.
B. C.
C. D.
D.
 与溴的四氯化碳溶液反应的化学反应方程式为
与溴的四氯化碳溶液反应的化学反应方程式为 .
. .
.