题目内容
14.下列关于晶体的说法正确的是( )| A. | 熔化二氧化硅和金刚石时所克服的粒子间的作用力类型同种 | |
| B. | 原子晶体的熔点一定比金属的高 | |
| C. | 构成分子晶体的微粒一定含有共价键 | |
| D. | 晶体中只要有阳离子就一定有阴离子 |
分析 A、二氧化硅和金刚石均为原子晶体;
B、某些金属晶体的熔点比原子晶体的熔点高;
C、稀有气体形成的分子晶体中不存在化学键;
D、金属晶体是由金属离子和自由电子构成的.
解答 解:A、二氧化硅和金刚石均为原子晶体,故熔化二氧化硅和金刚石时所克服的粒子间的作用力类型同种,故A正确;
B、原子晶体的熔点不一定比金属晶体的高,如金属钨的熔点比很多原子晶体的熔点高,故B错误;
C、分子晶体中的每个分子内不一定含有共价键,如稀有气体是单原子分子,它形成的分子晶体中不存在化学键,故C错误;
D、金属晶体是由金属离子和自由电子构成的,晶体中只有阳离子没有阴离子,故D错误;
故选A.
点评 本题考查化学键、晶体类型、熔沸点的比较,熟悉常见物质中的化学键并能举例即可解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列叙述不正确的是( )
| A. | Ca(ClO)2溶液中通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | |
| B. | 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入装有足量氯化钡溶液的洗气瓶中(如图装置),洗气瓶中产生的沉淀是硫酸钡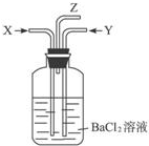 | |
| C. | 向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2 | |
| D. | 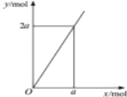 锌与不同浓度的硝酸可发生不同的反应(如图:y表示耗去Zn的物质的量,x表示被还原的硝酸的物质的量),4Zn+10HNO3(极稀)=4Zn(NO3)2+5H2O+N2O↑符合图示 |
5.下列关于中和热的说法不正确的是( )
| A. | 酸和碱发生中和反应时放出的热量不一定是57.3KJ | |
| B. | 酸和碱发生中和反应时所放出的热量就叫中和热 | |
| C. | 在稀溶液中,酸跟碱发生中和反应生成1mol水时所放出的热量称为中和热 | |
| D. | 中和热不包括物质溶解、电离、水合等过程中的热效应 |
2.若溶液中由水电离产生的c(OH-)=1×10-14 mol•L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
| A. | CH3COO- Na+ NO3- Cl- | B. | K+ Na+ Cl- NO3- | ||
| C. | K+ Na+ Cl- AlO2- | D. | K+ I- SO42- NO3- |
9.已知某酸H2B在水溶液中存在下列关系:①H2B?H++HB-,②HB-?H++B2-.关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )
| A. | NaHB属于弱电解质 | |
| B. | 溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-) | |
| C. | NaHB和NaOH溶液反应的离子方程式为H++OH-═H2O | |
| D. | c(Na+)=c(HB-)+c(B2-)+c(H2B) |
6.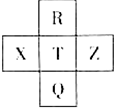 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:X<T<Q | B. | R与Q的电子数相差26 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | 简单离子的还原性:T>Q |
3.把a L含碳酸铵、氯化铵的溶液分成两等份,一份需用b mol烧碱刚好把氨全部赶出,另一份与氯化钡溶液反应时,消耗c mol氯化钡,由此可知原溶液中Cl-的物质的量浓度是(单位:mol•L-1)( )
| A. | $\frac{b-2c}{a}$ | B. | $\frac{b-2c}{2a}$ | C. | $\frac{2b-c}{a}$ | D. | $\frac{2b-4c}{a}$ |
16.已知100℃时,水的离子积常数为1×10-12.100℃时0.1mol•L-1的HX溶液中,$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-6,在该条件下对0.1mol•L-1的HX溶液,下列说法中正确的是( )
| A. | HX的电离方程式为:HX=H++X- | |
| B. | 该溶液中c(HX)>c (H+)>c (X-)>c (OH-) | |
| C. | 此溶液的pH=1 | |
| D. | NaX与HX的混合溶液pH=6时,溶液显酸性 |

 ;所含化学键类型为离子键、共价键(或离子键、非极性键);A晶体的晶胞中阳离子和阴离子的个数比为2:1.
;所含化学键类型为离子键、共价键(或离子键、非极性键);A晶体的晶胞中阳离子和阴离子的个数比为2:1. .
.