题目内容
12.将64g铜与200mL一定浓度的硝酸反应,铜完全溶解后,收集到标况下的混合气体体积为22.4L.将所得溶液加入5mol/L的NaOH溶液500ml,恰好将溶液中的Cu2+生成沉淀.((写出必要的计算过程及文字说明,无计算过程不得分))(1)被还原的硝酸的物质的量为1mol
(2)生成的NO的体积为11.2L
(3)原硝酸的浓度为15mol/L.
分析 (1)由3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O、Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,被还原的硝酸的物质的量等于气体的物质的量;
(2)n(Cu)$\frac{64g}{64g/mol}$=1mol,n(混合气体)=$\frac{22.4L}{22.4L/mol}$=1mol,设混合气体中NO和NO2的物质的量分别为x、y,结合原子守恒及电子守恒计算;
(3)由N原子守恒可知,原硝酸的物质的量为2n[Cu(NO3)2]+n(气体),结合c=$\frac{n}{V}$计算.
解答 解:(1)n(混合气体)=$\frac{22.4L}{22.4L/mol}$=1mol,被还原的硝酸的物质的量=气体的物质的量=1mol,故答案为:1mol;
(2)n(Cu)$\frac{64g}{64g/mol}$=1mol,n(混合气体)=$\frac{22.4L}{22.4L/mol}$=1mol,设混合气体中NO和NO2的物质的量分别为x、y,
由原子守恒及电子守恒可知,$\left\{\begin{array}{l}{x+y=1}\\{3x+y=1×2}\end{array}\right.$,解得x=0.5mol,y=0.5mol,生成的NO的体积为0.5mol×22.4/L=11.2L,故答案为:11.2L;
(3)由N原子守恒可知,原硝酸的物质的量为2n[Cu(NO3)2]+n(气体)=1mol×2+1mol=3mol,原硝酸浓度c=$\frac{n}{V}$=$\frac{3mol}{0.2L}$=15mol/L,故答案为:15mol/L.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应及电子守恒、原子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案| A. | NaF、NaCl、NaBr、NaI的熔点依次升高 | |
| B. | 熔点:铯>钾>钠>钠和钾的合金 | |
| C. | 熔沸点:HI>HBr>HCl>HF | |
| D. | 热稳定性:HF>HCl>HBr>HI |
| A. | 放热183 kJ | B. | 放热91.5 kJ | C. | 吸热183 kJ | D. | 吸热91.5 kJ |
| A. | Ca(ClO)2溶液中通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | |
| B. | 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入装有足量氯化钡溶液的洗气瓶中(如图装置),洗气瓶中产生的沉淀是硫酸钡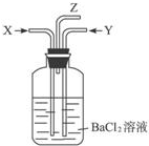 | |
| C. | 向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2 | |
| D. | 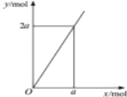 锌与不同浓度的硝酸可发生不同的反应(如图:y表示耗去Zn的物质的量,x表示被还原的硝酸的物质的量),4Zn+10HNO3(极稀)=4Zn(NO3)2+5H2O+N2O↑符合图示 |
| A. | 引进电动汽车,减少汽车尾气排放 | |
| B. | 大力发展火电,缓解用电紧张 | |
| C. | 开发太阳能、风能、氢能等清洁能源 | |
| D. | 积极推行和使用能被微生物降解的新型聚合物材料 |
| A. | CH3COO- Na+ NO3- Cl- | B. | K+ Na+ Cl- NO3- | ||
| C. | K+ Na+ Cl- AlO2- | D. | K+ I- SO42- NO3- |
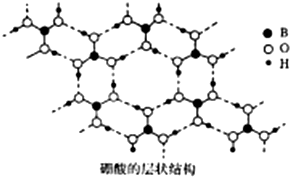 硼(B)及其化合物在化学中有重要的地位.请回答下列问题:
硼(B)及其化合物在化学中有重要的地位.请回答下列问题: [B(OH)4]-+H+.
[B(OH)4]-+H+.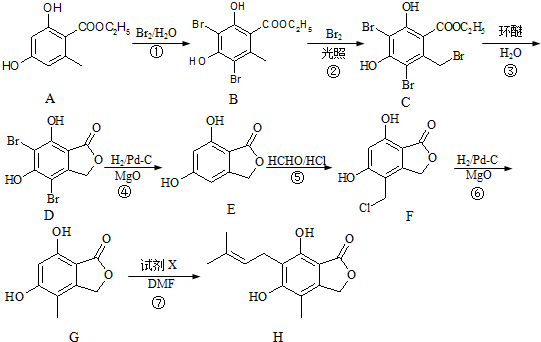
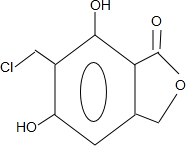 (任写一种).
(任写一种).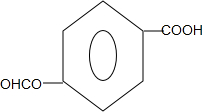 .
.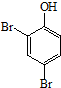 、HCHO为原料制备
、HCHO为原料制备 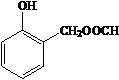 合成路线流程图(无机试剂任用).合成路线流程图示例如下:
合成路线流程图(无机试剂任用).合成路线流程图示例如下: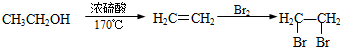
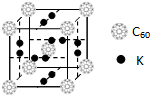 碳元素是构成物质种类最多的一种元素,许多物质与我们的生活息息相关.
碳元素是构成物质种类最多的一种元素,许多物质与我们的生活息息相关. ,该物质的K原子和C60分子的个数比为3:1.
,该物质的K原子和C60分子的个数比为3:1.