题目内容
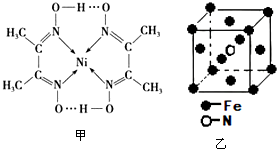
5.下列表示物质或微粒的化学用语或模型正确的是( )| A. | 氮分子的结构式:N-N | B. | Mg2+的结构示意图: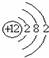 | ||
| C. | 二氧化碳电子式 | D. | 钙离子的电子式:Ca2+ |
分析 A.氮气分子中存在氮氮三键,不是单键;
B.镁离子的核外电子总数为10,最外层为8个电子;
C.二氧化碳分子中含有两个碳氧双键,碳原子最外层为8个电子;
D.钙离子为阳离子,其电子式直接用离子符号表示.
解答 解:A.氮气分子中含有氮氮三键,氮气的电子式为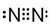 ,用短线代替所有共用电子对即为结构式,所以其结构式为N≡N,故A错误;
,用短线代替所有共用电子对即为结构式,所以其结构式为N≡N,故A错误;
B.镁离子的核电荷数为12,最外层为8个电子,镁离子的离子结构示意图为 ,故B错误;
,故B错误;
C.二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为 ,故C错误;
,故C错误;
D.钙离子简单阳离子,钙离子的电子式为Ca2+,故D正确;
故选D.
点评 本题考查了常见化学用语的判断,题目难度中等,涉及电子式、结构式、离子结构示意图等知识,注意掌握常见化学用语的书写原则,试题侧重考查学生的规范答题能力.

练习册系列答案
 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目
4.新闻:美国《科学》杂志12月17日评选出2004十大科学突破中,有多项与水有关,其中之一是关于对水的研究有新进展,一些科学家对于水分子如何聚合以及电子及质子如何在水中溶解等问题上,都有了新发现.另据 2004年4月14日中科院网报道,中科院物理所王恩哥小组他们首次证明存在一种稳定的二维冰相.它是由四角形和八角形的氢键网格交替组成的,研究人员把这种新的冰结构命名为镶嵌冰.有趣的是,这种镶嵌冰可以在室温下稳定存在.有关这种镶嵌冰的推测肯定不正确的( )
| A. | 镶嵌冰密度不可能比4℃水大 | |
| B. | 镶嵌冰中四角形环比八角形环中水分间的氢键键能强 | |
| C. | 每个水分子形成两个氢键 | |
| D. | 镶嵌冰属于分子晶体 |
5.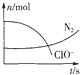 某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
 某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )| A. | 当有3molClO-参加反应时,则有1molN2生成 | |
| B. | HCO3-作为碱性介质参与反应 | |
| C. | 当有5molClO-参加反应时,则有1molN2生成 | |
| D. | 若生成2.24LN2,则转移电子0.6mol |
2.下列装置或操作能达到实验目的是( )
| A. |  实验室制取并收集NH3 | B. | 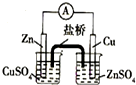 构成原电池 | ||
| C. | 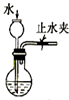 检查装置气密性 | D. |  利用排空气法收集CO2 |
10.人造地球卫星上使用的一种高能电池--银锌蓄电池,其电池的电极反应式为:Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-.据此判断氧化银是( )
| A. | 负极,被氧化 | B. | 正极,被还原 | C. | 负极,被还原 | D. | 正极,被氧化 |
17.下列溶液中微粒浓度关系正确的是( )
| A. | 室温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+) | |
| B. | pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+) | |
| C. | 0.1 mol•L-1的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1的NaHCO3溶液中:c(HCO3-)>c(CO32-)>c(H2CO3) |
15.某同学设计如下元素周期表,以下说法正确的是( )
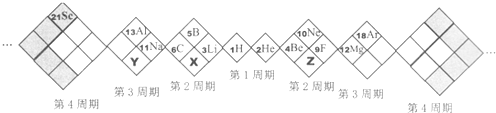

| A. | X、Y、Z元素分别为N、P、O | B. | 所列元素都是主族元素 | ||
| C. | 原子半径:Z>X>Y | D. | 稳定性:X的氢化物<Y的氢化物 |