题目内容
5. 某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )| A. | 当有3molClO-参加反应时,则有1molN2生成 | |
| B. | HCO3-作为碱性介质参与反应 | |
| C. | 当有5molClO-参加反应时,则有1molN2生成 | |
| D. | 若生成2.24LN2,则转移电子0.6mol |
分析 由曲线变化图可知,随反应进行ClO-的物质的量降低,N2的物质的量增大,故ClO-为反应物,N2是生成物,根据电子转移相等可知,CN-是反应物,由氯元素守恒可知Cl-是生成物,由碳元素守恒可知HCO3-是生成物,由氢元素守恒可知H2O是反应物.反应中Cl元素化合价由+1价降低为-1价,化合价总共降低2价,C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,化合价升降最小公倍数为2[(4-2)+(3-0)]=10价,故CN-系数为2,ClO-系数为5,由元素守恒可知HCO3-系数为2,N2系数为1,Cl-系数为5,H2O系数为1,反应方程式为2CN-+5ClO-+H2O=2HCO3-+N2↑+5Cl-,以此解答该题.
解答 解:反应方程式为2CN-+5ClO-+H2O=2HCO3-+N2↑+5Cl-,
A.由方程式可知,当有5molClO-参加反应时,则有1molN2生成,故A错误;
B.由方程式可知,HCO3-是生成物,故B错误;
C.由方程式可知,当有5molClO-参加反应时,则有1molN2生成,故C正确;
D.没有说明是标准状况,所以气体的物质的量无法计算,则转移电子无法计算,故D错误.
故选C.
点评 本题考查氧化还原反应的计算,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
相关题目
16.下列关于化学键的叙述,正确的一项是( )
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均存在化学键 | |
| C. | 含有非极性共价键的分子一定是单质分子 | |
| D. | 含有共价键的化合物一定是共价化合物 |
13.下列各组比较不正确的是( )
| A. | 锂与水反应不如钠与水反应剧烈 | |
| B. | 还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠 | |
| C. | 熔沸点:Li>Na>K | |
| D. | 原子半径:Li<Na<K |
20.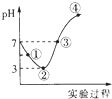 常温下,将Cl2缓慢通入100mL的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入100mL的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
 常温下,将Cl2缓慢通入100mL的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入100mL的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )| A. | ①处c(H+)约为②处c(H+)两倍 | |
| B. | 曲线③④段有离子反应:HClO+OH-═H2O+ClO- | |
| C. | 可以依据②处数据计算所得溶解的氯气的量n(Cl2) | |
| D. | ③处表示氯气与氢氧化钠恰好反应完全 |
17.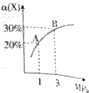 在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4kJ•mol-1,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4kJ•mol-1,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
 在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4kJ•mol-1,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4kJ•mol-1,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A. | 图中A、B两点,达到相同的平衡体系 | |
| B. | 上述反应在达到平衡后增大压强,X的转化率提高 | |
| C. | 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小 | |
| D. | 将1.0molX,3.0molY,置于1L密闭容器中发生反应,放出的热量为92.4kJ |
5.下列表示物质或微粒的化学用语或模型正确的是( )
| A. | 氮分子的结构式:N-N | B. | Mg2+的结构示意图: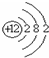 | ||
| C. | 二氧化碳电子式 | D. | 钙离子的电子式:Ca2+ |
6.下列不能说明氯元素的非金属性比硫元素强的事实( )
| A. | 氯化氢比硫化氢稳定 | B. | 次氯酸的氧化性比硫酸强 | ||
| C. | 高氯酸的酸性比硫酸的强 | D. | 氯气能与硫化氢反应生成硫 |