题目内容
15.某同学设计如下元素周期表,以下说法正确的是( )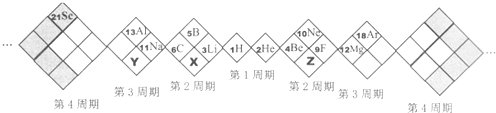
| A. | X、Y、Z元素分别为N、P、O | B. | 所列元素都是主族元素 | ||
| C. | 原子半径:Z>X>Y | D. | 稳定性:X的氢化物<Y的氢化物 |
分析 A、根据该同学涉及元素周期表的形式和位置可知:X的原子序数为7,Z的原子序数为8,Y的原子序数为15,因此X为N,Z为O,Y为P;
B、白格中的He、Ne、Ar不属于主族元素;
C、根据同周期自左到右原子半径逐渐减小,同主族自上而下原子半径逐渐增大判断;
D、根据非金属性越强,形成的气态氢化物越稳定判断.
解答 解:A、根据该同学涉及元素周期表的形式和位置可知:X的原子序数为7,Z的原子序数为8,Y的原子序数为15,因此X为N,Z为O,Y为P,故A正确;
B、白格中的稀有气体He、Ne、Ar不属于主族元素,故B错误;
C、同周期自左到右原子半径逐渐减小,原子半径N>O,同主族自上而下原子半径逐渐增大,原子半径P>N,因此原子半径P>N>O,故C错误;
D、非金属性:O>N>P,非金属性越强,形成的气态氢化物越稳定,因此形成的气态氢化物最稳定的是H2O,故D错误;
故选:A.
点评 本题通过该同学设计的元素周期表推知X、Y、Z的原子序数,从而确定所代表的元素种类,侧重于考查元素周期律中原子半径大小、非金属性的强弱等规律,难度中等,变的是元素周期表的形式,不变的是元素周期律.

练习册系列答案
相关题目
5.下列表示物质或微粒的化学用语或模型正确的是( )
| A. | 氮分子的结构式:N-N | B. | Mg2+的结构示意图: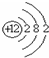 | ||
| C. | 二氧化碳电子式 | D. | 钙离子的电子式:Ca2+ |
6.下列不能说明氯元素的非金属性比硫元素强的事实( )
| A. | 氯化氢比硫化氢稳定 | B. | 次氯酸的氧化性比硫酸强 | ||
| C. | 高氯酸的酸性比硫酸的强 | D. | 氯气能与硫化氢反应生成硫 |
3.在人类社会的发展进程中,金属起着重要的作用.下列说法正确的是( )
| A. | 地球上绝大多数金属元素是以游离态存在于自然界中的 | |
| B. | 在化学反应中,金属容易失去电子,是还原剂 | |
| C. | 多数合金的熔点高于组成它的成分的金属的熔点 | |
| D. | 硅单质是良好的半导体,所以它是金属元素 |
20.下列说法正确的是( )
| A. | SiO2是太阳能电池的主要原料 | |
| B. | 油脂和蛋白质都是高分子化合物 | |
| C. | 金属的镀层被破坏后,镀锌铁比镀铜铁更容易被腐蚀 | |
| D. | 明矾净水是因为能生成有吸附性的物质 |
4.下列溶液混合后,常温下溶液一定呈碱性的是( )
| A. | pH=12的氢氧化钠溶液与pH=2的某酸溶液等体积混合 | |
| B. | pH=2的某酸溶液与pH=12某碱溶液等体积混合 | |
| C. | pH=2的盐酸pH=12的氨水等体积混合 | |
| D. | 1×10-3mol/L的盐酸和6×10-4mol/L的Ba(OH)2溶液各取10mL,混合后再稀释100倍 |
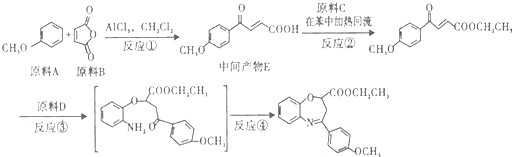
 (写出其结构简式).
(写出其结构简式).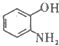 .
.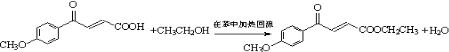 .
.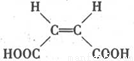 )的酸酐,它可以经下列变化分别得到苹果酸(
)的酸酐,它可以经下列变化分别得到苹果酸( )和聚合物Q:
)和聚合物Q: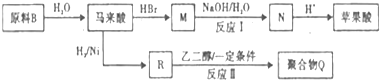
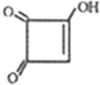 .
.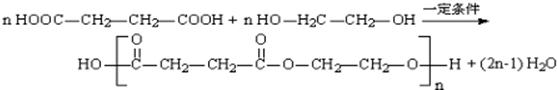 .
.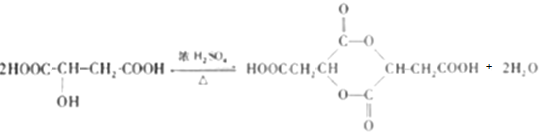 .
.