题目内容
9.已知:碳、氮、氢、氧四种元素可形成多种化合物,且有非常重要的用途.(1)C、N、H电负性的大小顺序为N>C>H.
(2)甲烷与二氧化氮可发生如下反应:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g),若反应中有2mol C-H键断裂,则形成的π键共有2 mol.
(3)F2与NH3在一定条件下可形成NF3,NF3分子的空间构型为三角锥形.
(4)现已合成出一种硬度比金刚石还大的晶体氮化碳,其化学式为C3N4.其硬度比金刚石大的主要原因是氮化碳与金刚石均属于原子晶体,其氮碳键的键长比金刚石晶体中碳碳键的键长更短.
(5)配合物Y的结构如图甲所示,Y中含有ABCD(填序号).

A.非极性共价键 B.配位键 C.极性键 D.氢键 E.金属键
Y中碳原子的杂化方式有sp3、sp2.
写出镍 (Ni)原子的价电子排布式3d84s2.
(6)氨气与铁在一定条件下发生置换反应,一种产物的晶胞结构如图乙所示,若该立方体晶胞的棱长为a pm,则该晶体的密度为$\frac{2.38×1{0}^{32}}{{a}^{3}{N}_{A}}$g/cm3 (NA为阿佛加德罗常数的值).
分析 (1)元素的非金属性越强,其电负性越大,同一周期元素,元素的电负性随着原子序数增大而增大;
(2)CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g)中如果有1mol甲烷完全反应,有4molC-H键断裂,同时有4molπ键形成,若反应中有2mol C-H键断裂,则有0.5mol甲烷参加反应,根据甲烷和π键之间的关系式计算;
(3)NF3分子中N原子价层电子对个数是4且含有一个孤电子对,据此判断空间构型;
(4)该化合物中电负性N>C,所以N元素呈现负价、C元素呈现正化合价,N元素为-3价、C元素为+4价,根据化合物中化合价的代数和为0确定化学式;
原子晶体中,键长越长,晶体熔沸点越低;
(5)同种非金属元素之间存在非极性键、不同非金属元素之间存在极性键,含有孤电子对和含有空轨道的原子之间存在配位键;羟基中氢原子和另外的O原子之间存在氢键;
根据价层电子对互斥理论确定C原子杂化类型;
Ni为28号元素,其基态原子核外有28个电子,其3d、4s电子为价电子,根据构造原理书写其价电子排布式;
(6)该晶胞中Fe原子个数=6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,N原子个数为1,其化学式为Fe4N,晶胞的棱长=a×10-10cm,体积为(a×10-10cm)3,该晶胞密度=$\frac{m}{V}$.
解答 解:(1)元素的非金属性越强,其电负性越大,同一周期元素,元素的电负性随着原子序数增大而增大,非金属性强弱顺序是N>C>H,所以电负性大小顺序是N>C>H,
故答案为:N>C>H;
(2)CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g)中如果有1mol甲烷完全反应,有4molC-H键断裂,同时有4molπ键形成,若反应中有2mol C-H键断裂,则有0.5mol甲烷参加反应,根据甲烷和π键之间的关系式知,生成2molπ键,故答案为:2;
(3)NF3分子中N原子价层电子对个数是4且含有一个孤电子对,其空间构型和氨气相似,为三角锥形,故答案为:三角锥;
(4)该化合物中电负性N>C,所以N元素呈现负价、C元素呈现正化合价,N元素为-3价、C元素为+4价,根据化合物中化合价的代数和为0知,其化学式为C3N4;
原子晶体中,键长越长,晶体熔沸点越低,氮化碳与金刚石均属于原子晶体,其氮碳键的键长比金刚石晶体中碳碳键的键长更短,所以硬度比金刚石大;
故答案为:C3N4;氮化碳与金刚石均属于原子晶体,其氮碳键的键长比金刚石晶体中碳碳键的键长更短;
(5)同种非金属元素之间存在非极性键、不同非金属元素之间存在极性键,含有孤电子对和含有空轨道的原子之间存在配位键;羟基中氢原子和另外的O原子之间存在氢键,所以C-C原子之间存在非极性键、C-N和C-H原子之间存在极性键、Ni-N原子之间存在配位键、羟基中H原子和另外的O原子之间存在氢键,故选ABCD;
根据价层电子对互斥理论知,甲基上C原子价层电子对为4,其杂化方式为sp3;连接甲基的C原子价层电子对个数是3,碳原子杂化方式为sp2;
Ni为28号元素,其基态原子核外有28个电子,其3d、4s电子为价电子,根据构造原理书写其价电子排布式为3d84s2,
故答案为:ABCD;sp3、sp2;3d84s2;
(6)该晶胞中Fe原子个数=6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,N原子个数为1,其化学式为Fe4N,晶胞的棱长=a×10-10cm,体积为(a×10-10cm)3,该晶胞密度=$\frac{m}{V}$=$\frac{\frac{M}{{N}_{A}}}{V}$=$\frac{\frac{238}{{N}_{A}}}{(a×1{0}^{-10})^{3}}$g/cm3=$\frac{2.38×1{0}^{32}}{{a}^{3}{N}_{A}}$g/cm3.
故答案为:$\frac{2.38×1{0}^{32}}{{a}^{3}{N}_{A}}$.
点评 本题考查晶胞计算、原子杂化、微粒空间构型、化学键等知识点,侧重考查学生分析计算能力,这些都是高频考点,知道价层电子对互斥理论的应用,难点是晶胞计算,知道$\frac{\frac{M}{{N}_{A}}}{V}$中各个字母的含义,题目难度中等.

| A. | △H2<△H3 | B. | △H1>△H3 | C. | △H1+△H3=△H2 | D. | △H1+△H2>△H3 |
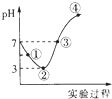 常温下,将Cl2缓慢通入100mL的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入100mL的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )| A. | ①处c(H+)约为②处c(H+)两倍 | |
| B. | 曲线③④段有离子反应:HClO+OH-═H2O+ClO- | |
| C. | 可以依据②处数据计算所得溶解的氯气的量n(Cl2) | |
| D. | ③处表示氯气与氢氧化钠恰好反应完全 |
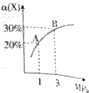 在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4kJ•mol-1,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4kJ•mol-1,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A. | 图中A、B两点,达到相同的平衡体系 | |
| B. | 上述反应在达到平衡后增大压强,X的转化率提高 | |
| C. | 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小 | |
| D. | 将1.0molX,3.0molY,置于1L密闭容器中发生反应,放出的热量为92.4kJ |
| A. | 2 种 | B. | 3 种 | C. | 4 种 | D. | 5 种 |
| A. | 氮分子的结构式:N-N | B. | Mg2+的结构示意图: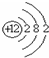 | ||
| C. | 二氧化碳电子式 | D. | 钙离子的电子式:Ca2+ |
| A. | 甲快 | B. | 乙快 | C. | 相等 | D. | 无法确定 |
①硒位于周期表第4周期,VIA族;
②硒的最高价氧化物的化学式为SeO3,对应水化物的化学式为H2SeO4;
(2)如表是某一周我国部分城市空气质量周报,阅读并回答下列问题.
| 城市 | 污染指数 | 首要污染物 | 空气质量级别 |
| 北京 | 92 | TSP | Ⅱ |
| 上海 | 74 | Ⅱ | |
| 济南 | 76 | TSP | Ⅱ |
| 重庆 | 98 | Ⅱ |
②二氧化硫是常见的大气污染物之一,我国规定空气中二氧化硫含量不得超过0.02mg/L.为减少二氧化硫排放量,下列措施中,可采取的是AB.
A.用天然气代替煤炭做民用燃料
B.采用燃料脱硫技术
C.向已酸化的土壤中加石灰
D.植树造林.