题目内容
17.下列溶液中微粒浓度关系正确的是( )| A. | 室温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+) | |
| B. | pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+) | |
| C. | 0.1 mol•L-1的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1的NaHCO3溶液中:c(HCO3-)>c(CO32-)>c(H2CO3) |
分析 A、根据电荷守恒,得c(Cl-)+c(OH-)=c(NH4+)+c(H+),结合溶液的PH=7综合分析解答;
B、酸碱的强弱未知,反应后不一定呈中性;
C、NH4+水解,溶液呈酸性;
D、NaHCO3溶液呈碱性,说明水解程度大于电离.
解答 解:A、氨水与氯化铵的pH=7的混合溶液中存在c(Cl-)+c(OH-)=c(NH4+)+c(H+),因c(OH-)=c(H+),则c(Cl-)=c(NH4+),故A正确;
B、酸碱的强弱未知,反应后不一定呈中性,如为强酸强碱,则c(OH-)=c(H+),如为弱酸强碱,则c(OH-)<c(H+),如为强酸弱碱,则c(OH-)>c(H+),故B错误;
C、NH4+水解,且水解程度较小,溶液呈酸性,则存在c(NH4+)>c(SO42-)>c(H+)>c(OH-),故C正确;
D、因为水解程度大于电离,所以离子浓度的大小关系为:c(HCO3-)>c(H2CO3)>c(CO32-),故D错误;
故选AC.
点评 本题考查离子浓度的大小比较,题目难度中等,本题注意弱电解质的电离以及盐类水解原理的把握,注意电荷守恒及物料守恒的应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列关于化学键的叙述,正确的一项是( )
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均存在化学键 | |
| C. | 含有非极性共价键的分子一定是单质分子 | |
| D. | 含有共价键的化合物一定是共价化合物 |
17.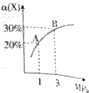 在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4kJ•mol-1,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4kJ•mol-1,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
 在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4kJ•mol-1,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4kJ•mol-1,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A. | 图中A、B两点,达到相同的平衡体系 | |
| B. | 上述反应在达到平衡后增大压强,X的转化率提高 | |
| C. | 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小 | |
| D. | 将1.0molX,3.0molY,置于1L密闭容器中发生反应,放出的热量为92.4kJ |
5.下列表示物质或微粒的化学用语或模型正确的是( )
| A. | 氮分子的结构式:N-N | B. | Mg2+的结构示意图: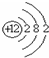 | ||
| C. | 二氧化碳电子式 | D. | 钙离子的电子式:Ca2+ |
12.甲、乙两个容器内都在进行A→B的反应,甲中每分钟减少4mol A,乙中每分钟减少2mol A,则两容器中的反应速率( )
| A. | 甲快 | B. | 乙快 | C. | 相等 | D. | 无法确定 |
2.氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料.
(1)以氨为燃料可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用.若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O.
(2)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2?2NH3.该可逆反应达到平衡的标志是BCE.
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
E.a molN≡N键断裂的同时,有6amolN-H键断裂
F.N2、H2、NH3的分子数之比为1:3:2
(3)某化学研究性学习小组模拟工业合成氨的反应.在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
则从反应开始到25min时,以N2表示的平均反应速率=0.01mol/(L.min);该温度下平衡常数K=2.37(mol/L)-2;(要写K的单位)
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-l59.5kJ•mol-1
②NH2CO2NH4(s)?CO(NH2)2(s)+H2O(g)△H=+116.5kJ•mol-1
③H2O(1)═H2O(g)△H=+44.0kJ•mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-87.0kJ•mol-1;
对于上述反应②在密闭容器中将过量NH2CO2NH4固体于400K下分解,平衡时体系压强为a Pa,若反应温度不变,将体系的体积增加50%,则体系的压强是a Pa(用含a的式子表示).
(1)以氨为燃料可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用.若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O.
(2)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2?2NH3.该可逆反应达到平衡的标志是BCE.
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
E.a molN≡N键断裂的同时,有6amolN-H键断裂
F.N2、H2、NH3的分子数之比为1:3:2
(3)某化学研究性学习小组模拟工业合成氨的反应.在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-l59.5kJ•mol-1
②NH2CO2NH4(s)?CO(NH2)2(s)+H2O(g)△H=+116.5kJ•mol-1
③H2O(1)═H2O(g)△H=+44.0kJ•mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-87.0kJ•mol-1;
对于上述反应②在密闭容器中将过量NH2CO2NH4固体于400K下分解,平衡时体系压强为a Pa,若反应温度不变,将体系的体积增加50%,则体系的压强是a Pa(用含a的式子表示).
9.(1)硒(Se)是人体必需微量元素.已知在周期表中,硒与氧同主族,与钙同周期,试回答下列问题:
①硒位于周期表第4周期,VIA族;
②硒的最高价氧化物的化学式为SeO3,对应水化物的化学式为H2SeO4;
(2)如表是某一周我国部分城市空气质量周报,阅读并回答下列问题.
①最容易出现酸雨的城市应是重庆.
②二氧化硫是常见的大气污染物之一,我国规定空气中二氧化硫含量不得超过0.02mg/L.为减少二氧化硫排放量,下列措施中,可采取的是AB.
A.用天然气代替煤炭做民用燃料
B.采用燃料脱硫技术
C.向已酸化的土壤中加石灰
D.植树造林.
①硒位于周期表第4周期,VIA族;
②硒的最高价氧化物的化学式为SeO3,对应水化物的化学式为H2SeO4;
(2)如表是某一周我国部分城市空气质量周报,阅读并回答下列问题.
| 城市 | 污染指数 | 首要污染物 | 空气质量级别 |
| 北京 | 92 | TSP | Ⅱ |
| 上海 | 74 | Ⅱ | |
| 济南 | 76 | TSP | Ⅱ |
| 重庆 | 98 | Ⅱ |
②二氧化硫是常见的大气污染物之一,我国规定空气中二氧化硫含量不得超过0.02mg/L.为减少二氧化硫排放量,下列措施中,可采取的是AB.
A.用天然气代替煤炭做民用燃料
B.采用燃料脱硫技术
C.向已酸化的土壤中加石灰
D.植树造林.
6.下列不能说明氯元素的非金属性比硫元素强的事实( )
| A. | 氯化氢比硫化氢稳定 | B. | 次氯酸的氧化性比硫酸强 | ||
| C. | 高氯酸的酸性比硫酸的强 | D. | 氯气能与硫化氢反应生成硫 |
 (写出其结构简式).
(写出其结构简式).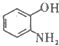 .
.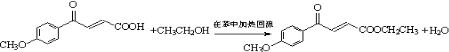 .
.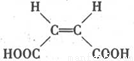 )的酸酐,它可以经下列变化分别得到苹果酸(
)的酸酐,它可以经下列变化分别得到苹果酸( )和聚合物Q:
)和聚合物Q: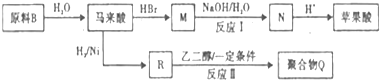
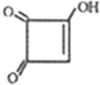 .
.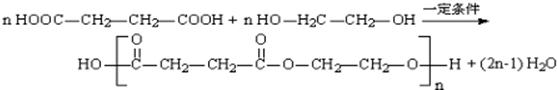 .
.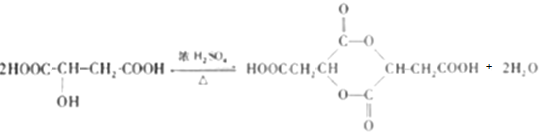 .
.