题目内容
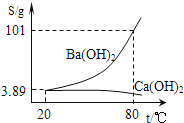
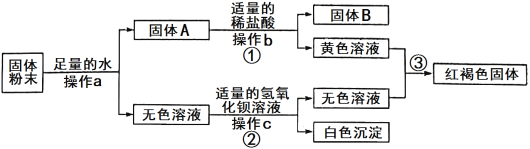
【题目】R是硝酸钾或氯化铵中的一种,硝酸钾和氯化铵的溶解度曲线如图1所示。某化学兴趣小组的同学进行了如图2所示实验。
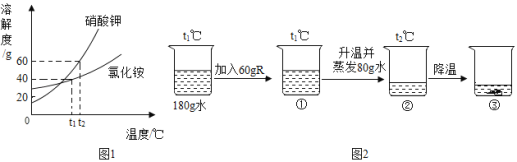
(1)t2℃时,比较硝酸钾和氯化铵的饱和溶液中溶质质量分数的大小关系是硝酸钾 ____________氯化铵(选填“大于”、“小于”或“等于”)。
(2)根据以上图 1、图 2 信息可推出 R 是_____________(填“KNO3”或“NH4Cl”)。
(3)关于图 2 中烧杯内的物质,以下几种说法正确的有____(填字母)。
A ①和②的溶液中,溶质质量相等
B 若使③中的固体溶解,可采用加水或升温的方法
C ①的溶液中溶质质量分数一定比③的上层清液中溶质质量分数小
(4)欲将 100g 溶质质量分数为 20%的硝酸钾溶液稀释为 10%的硝酸钾溶液备用,所需水的体积为_________ mL。
【答案】大于 ![]() AB 100
AB 100
【解析】
(1)t2℃时,硝酸钾的溶解度大于氯化铵的溶解度,所以比较硝酸钾和氯化铵的饱和溶液中溶质质量分数的大小关系是硝酸钾大于氯化铵;
(2)t2℃时,100g的水中会溶解60g的固体,氯化铵的溶解度小于60g,所以根据以上图1、图2信息可推出R是![]() ;
;
(3)A、①和②的溶液中,溶质质量都是60g,所以质量相等,故说法正确;
B、硝酸钾的溶解度随温度的升高而增大,所以若使③中的固体溶解,可采用加水或升温的方法,故说法正确;
C、③中析出晶体的质量不能确定,所以①的溶液中溶质质量分数与③的上层清液中溶质质量分数不能确定,故说法错误;
故选:AB;
(4)欲将100g溶质质量分数为20%的硝酸钾溶液稀释为10%的硝酸钾溶液备用,所需水的质量为:![]() ,所以水的体积为100 mL。
,所以水的体积为100 mL。

 高中必刷题系列答案
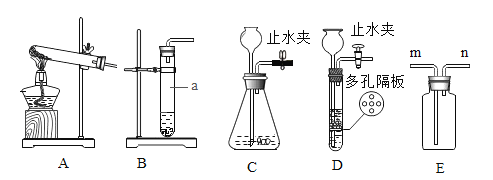
高中必刷题系列答案【题目】设计对比试验,控制变量是学习化学的重要方法,下列对比试验不能达到目的是( )
编号 | A | B | C | D |
实验设计 |
|
|
|
|
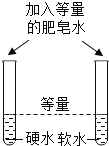
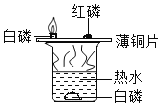
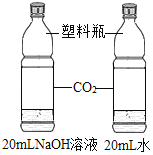
实验目的 | 区分硬水和软水 | 探究可燃物燃烧的条件 | 探究铁生锈的条件 | 探究 CO2与 NaOH 溶液能否发生反应 |
A.AB.BC.CD.D