题目内容
【题目】暖宝宝是一种防寒用品,标签如图。

资料:吸水树脂,一种新型的高分子材料,它能够吸收自身重量几百倍至千倍的水分,吸水能力特强,保水能力特高,并且可反复释水、吸水。
(1)取A、B两袋“暖宝宝”,将A袋按使用说明打开外袋取出内袋;而B袋不打开外袋,并将两袋样品放置在同样的环境中,A袋的“暖宝宝”温度很快上升;B袋温度_____。
(2)24小时后,分别剪开A、B两袋,各取少量袋内物质于两支试管中,分别加入足量稀盐酸,A袋内的物质,产生黄色溶液;B袋内的物质_____。写出A中物质发生反应的化学方程式_____。
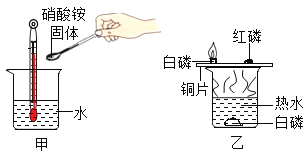
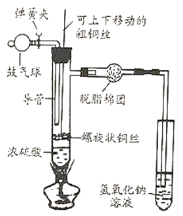
(3)暖宝宝为什么会发热?同学们在老师的帮助下,设计了如图1所示实验装置,分别利用湿度传感器、氧气浓度传感器和温度传感器验证“暖宝宝”放热是由于铁在___作用发生缓慢氧化,将___能转化为_____能。

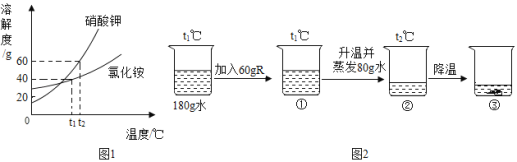
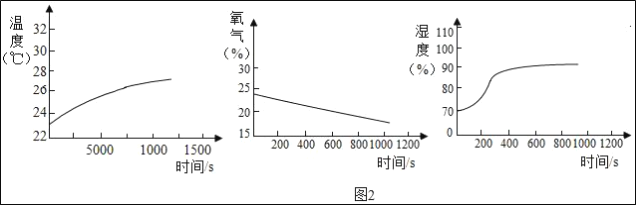
(4)由图2中图象分析,小林发现_____传感器测得的曲线与所学的知识不相符,原因可能与“暖宝宝”原材料中的_____有关。
(5)铁钉生锈需要较长时间,而“暖宝宝”能快速放热的原因可能是_____/_____(写两点即可)
【答案】没有明显变化 部分溶解,有气泡产生,溶液为浅绿色 Fe2O3+6 HCl═2FeCl3+3H2O 氧气和水 化学 热 湿度 吸水树脂 氯化钠能加快铁生锈 铁呈粉末状,与水和氧气的接触面积大
【解析】
(1)B袋不打开外袋,不与水和氧气接触,故B袋温度没有明显变化。
(2)A袋内铁生锈变成氧化铁,氧化铁与盐酸反应生成氯化铁和水,溶液变黄,其中的活性炭不参与反应,故会有固体残留,B袋内的铁没有生锈,铁与盐酸反应生成氯化亚铁和氢气,会观察到有气泡产生,溶液变成浅绿色,其中的活性炭不参与反应,故会有固体残留,化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O。
(3)铁在氧气和水的共同作用发生缓慢氧化,将化学能转化为热能。
(4)由图2中图象分析,小林发现湿度传感器测得的曲线逐渐升高,故可能与“暖宝宝”原材料中的吸水树脂有关。
(5)“暖宝宝”能快速放热的原因可能是其中的氯化钠能加快铁生锈;铁呈粉末状,与水和氧气的接触面积大。

【题目】为探究盐酸的化学性质,某化学小组做了如下实验:
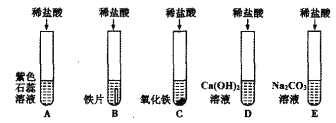
(1)A试管中的实验现象为______________,C试管中所发生反应的化学方程式为____________。
(2)将反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行探究。
(提出问题)滤液中溶质的成分是什么?
(作出猜想)猜想:NaCl
猜想二:NaCl和CaCl2
猜想三:______________
猜想四:NaCl、Ca(OH)2和HCl
(设计实验)请完成实验报告。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量的碳酸钠溶液。 | _________ | 猜想二不成立 |
取少量滤液于试管中, 滴加_______(填名称)。 | _________ | 猜想三成立 |
(迁移拓展)稀盐酸、稀硫酸有一些相似的化学性质,是因为在不同的酸溶液中都含有__________。