题目内容
【题目】金属铜与稀硫酸不能发生反应,但将铜加入浓硫酸中,在加热条件下会发生如下反应:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2X。下列有关叙述中,不正确的是( )
CuSO4+SO2↑+2X。下列有关叙述中,不正确的是( )
A.在上述反应中,涉及到三类化合物
B.浓硫酸与稀硫酸的化学性质不同
C.反应生成的X是H2O
D.20g98%的浓硫酸,与足量的铜反应,能产生6.4g二氧化硫
【答案】D
【解析】
反应的方程式 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2X,依据反应前后原子的种类和数目不变,反应前铜原子、氢原子、硫原子和氧原子的数目分别为:1、4、2、8,反应后铜原子、氢原子、硫原子和氧原子的数目分别为:1、0、2、6,所以2X中含4个氢原子、2个氧原子,可以推出X的化学式为H2O。
CuSO4+SO2↑+2X,依据反应前后原子的种类和数目不变,反应前铜原子、氢原子、硫原子和氧原子的数目分别为:1、4、2、8,反应后铜原子、氢原子、硫原子和氧原子的数目分别为:1、0、2、6,所以2X中含4个氢原子、2个氧原子,可以推出X的化学式为H2O。
A. 在上述反应中,涉及到化合物有:H2SO4(酸)、CuSO4(盐)、SO2(氧化物)、H2O(氧化物)四种,酸、盐和氧化物三类。故A不符合题意;
B. 金属铜能与浓硫酸反应,不与稀硫酸反应,所以浓硫酸与稀硫酸的化学性质不同说法正确。故B不符合题意;
C. 由以上分析可知,反应生成的X是H2O。故C不符合题意;
D. 20g98%的浓硫酸,含硫酸溶质的质量为![]() ,与足量的铜反应,设生成的二氧化硫的质量为X,
,与足量的铜反应,设生成的二氧化硫的质量为X,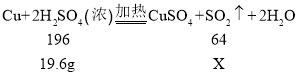 ,
,![]() ,解得X=6.4g,理论上能产生6.4g二氧化硫,但是随着反应进行,98%的浓硫酸浓度会逐渐变稀,稀硫酸不与铜反应。生成的二氧化硫质量达不到6.4g的理论值。故D符合题意。
,解得X=6.4g,理论上能产生6.4g二氧化硫,但是随着反应进行,98%的浓硫酸浓度会逐渐变稀,稀硫酸不与铜反应。生成的二氧化硫质量达不到6.4g的理论值。故D符合题意。
故选D。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
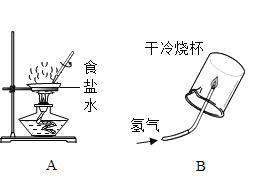
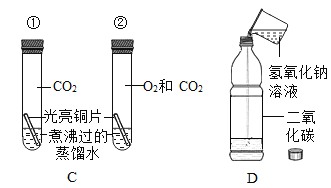
黄冈天天练口算题卡系列答案【题目】为探究盐酸的化学性质,某化学小组做了如下实验:
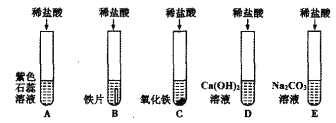
(1)A试管中的实验现象为______________,C试管中所发生反应的化学方程式为____________。
(2)将反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行探究。
(提出问题)滤液中溶质的成分是什么?
(作出猜想)猜想:NaCl
猜想二:NaCl和CaCl2
猜想三:______________
猜想四:NaCl、Ca(OH)2和HCl
(设计实验)请完成实验报告。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量的碳酸钠溶液。 | _________ | 猜想二不成立 |
取少量滤液于试管中, 滴加_______(填名称)。 | _________ | 猜想三成立 |
(迁移拓展)稀盐酸、稀硫酸有一些相似的化学性质,是因为在不同的酸溶液中都含有__________。
【题目】实验室有一瓶标签模糊的氢氧化钠溶液,为了测定其溶质质量分数,小明进行了如下实验:①取一洁净的锥形瓶称量,然后往其中加入一定量的氢氧化钠溶液,并滴入几滴酚酞试液(质量忽略不计),重新称量;②往上述锥形瓶中加入溶质质量分数为7.3%的盐酸,边加边振荡,溶液红色褪去时,再次称量。数据如下表:回答下列问题:
锥形瓶/g | 锥形瓶+氢氧化钠溶液/g | 锥形瓶+反应后溶液/g | |
质量/g | 35.5 | 60.5 | 110.5 |
(1)根据表中数据,通过计算确定该瓶氢氧化钠溶液的溶质质量分数_________。
(2)小建用pH试纸测得小明实验反应后锥形瓶内溶液的pH为4,则小明测出氢氧化钠溶液的质量分数比实际浓度_________(选填“偏大”或“偏小”),造成这一偏差的原因是________。