题目内容
【题目】氯化钡是一种可溶性重金属盐。工业上用毒重石(主要成分是BaCO3)制备氯化钡晶体。某实验小组模拟工业上制备氯化钡晶体的流程,设计了实验室中制备氯化钡晶体的方案,实验流程如图所示。(该毒重石样品所含杂质难溶于水,不与酸反应。)

(1)步骤①中发生反应的化学方程式为_____。
(2)滤液Ⅱ是30℃时氯化钡的_____溶液(选填“饱和”或“不饱和”);洗涤氯化钡晶体最适宜的洗涤剂是_____(填字母序号)。
A 30℃水 B 30℃饱和氯化钠溶液 C 30℃饱和氯化钡溶液
(3)关于上述实验方案的相关内容,下列说法不正确的是_____(填字母序号)。
A 氯化钡是一种有毒的物质,使用时应注意安全
B 该实验流程中得到的副产品二氧化碳是重要的化工原料
C 可用重晶石(主要成分是硫酸钡)代替该实验流程中的毒重石,制备氯化钡晶体
D 步骤②将滤渣进行水洗,既能提高氯化钡晶体的产率,又能减少Ba2+对环境的污染
(4)某同学提出,步骤③将滤液Ⅰ浓缩时会产生气体污染物,其化学式为_____。为防止污染,需要对滤液Ⅰ处理后再浓缩。处理滤液Ⅰ用到稍过量甲试剂,该试剂是_____(填字母序号)。
A Ba(OH)2 B BaCl2 C Ba(NO3)2 D BaCO3
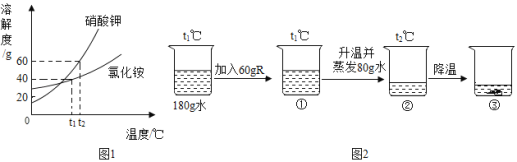
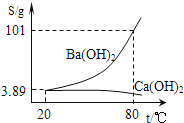
(5)实验室有一份混有碳酸钙杂质的碳酸钡样品。分离并提纯碳酸钡的实验步骤如下,请根据要求填空(如图为Ba(OH)2和Ca(OH)2的溶解度曲线):
①高温灼烧碳酸钡和碳酸钙的混合物,直至完全分解。碳酸钡和碳酸钙化学性质相似,写出碳酸钡高温分解的化学方程式_____。
②将灼烧后的固体混合物置于80℃的热水中,制成氢氧化钡的热饱和溶液。为减少Ba(OH)2的损失并除去不溶物应进行的操作是_____(选填字母);
A 冷却过滤 B 趁热过滤
③将“②”中滤液冷却结晶并过滤,得到的Ba(OH)2固体中不会含Ca(OH)2,因为_____。
④将“③”中制得的固体溶于水制成溶液。并向制得的溶液中滴加酚酞试剂,再通入二氧化碳。当观察到_____时,Ba(OH)2恰好全部生成BaCO3沉淀,即可停止通二氧化碳。
⑤滤出碳酸钡沉淀,经_____(填一种操作)、干燥后即得到纯净的碳酸钡。
【答案】![]() 饱和 C C HCl D
饱和 C C HCl D 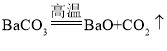 B 冷却析出Ba(OH)2的过程中Ca(OH)2溶解度增大 红色刚好消失 洗涤
B 冷却析出Ba(OH)2的过程中Ca(OH)2溶解度增大 红色刚好消失 洗涤
【解析】
碳酸钡和盐酸反应生成氯化钡、水和二氧化碳,碳酸钡高温生成氧化钡和二氧化碳,二氧化碳和氢氧化钡反应生成碳酸钡和水。
(1)步骤①中发生反应是碳酸钡和盐酸反应生成氯化钡、水和二氧化碳,反应的化学方程式为![]() 。
。
(2)滤液Ⅱ是过滤晶体得到,故滤液Ⅱ是30℃时氯化钡的饱和溶液。洗涤晶体时应将晶体表面吸附的离子除去且应抑制氯化钡的溶解,则应选择30℃饱和氯化钡溶液,故选C。
(3)A、氯化钡是重金属盐,属于有毒的物质,使用时应注意安全,故A正确;
B、副产品二氧化碳可用于生成碳酸饮料、植物肥料等,是重要的化工原料,故B正确;
C、硫酸钡不溶于水也不和酸反应,不可用重晶石(主要成分是硫酸钡)代替该实验流程中的毒重石,制备氯化钡晶体,故C不正确;
D、步骤②将滤渣进行水洗,既能提高氯化钡晶体的产率,又能减少 Ba2+环境的污染,故D正确。故选C。
(4)步骤③将滤液Ⅰ浓缩时会产生气体污染物,盐酸过量,浓缩时挥发出氯化氢气体,其化学式为HCl,为防止污染,需要对滤液Ⅰ处理后再浓缩。为避免引入新的杂质,可以用适量的碳酸钡,盐酸和碳酸钡生成氯化钡、水和二氧化碳,处理滤液Ⅰ用到稍过量甲试剂,该试剂是碳酸钡,故选D。
(5)①碳酸钡和碳酸钙化学性质相似,碳酸钙高温生成氧化钙和二氧化碳,则碳酸钡高温生成氧化钡和二氧化碳,碳酸钡高温分解的化学方程式为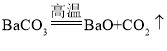 。
。
②氢氧化钡的溶解度随温度的升高而增大,为减少Ba(OH)2的损失并除去不溶物应进行的操作是趁热过滤,故选B。
③氢氧化钡的溶解度随温度的升高而增大,氢氧化钙的溶解度随温度的升高而减小,将“②”中滤液冷却结晶并过滤,得到的Ba(OH)2固体中不会含Ca(OH)2,因为冷却析出Ba(OH)2的过程中Ca(OH)2溶解度增大。
④氢氧化钡溶液呈碱性,滴加酚酞试液溶液呈红色,当通入二氧化碳会生成碳酸钡固体和水,溶液呈中性,溶液由红色变成无色,故当观察到红色刚好消失时,Ba(OH)2恰好全部生成BaCO3沉淀,即可停止通二氧化碳。
⑤滤出碳酸钡沉淀,经洗涤、干燥后即得到纯净的碳酸钡。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】根据下图回答问题。
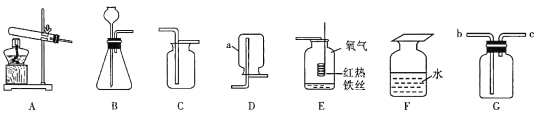
(1)仪器a的名称是_______。
(2)实验室用B装置制氧气的化学方程式为_______。装置E中发生反应的化学方程式为______
(3)实验室常使用仪器G来收集气体,若现在要收集氢气,则气体从__________(填“b”或“c”)端进入;有同学认为只要经过一定的改进措施,氧气也能从该端进入收集,则他的改进措施可能是________。
(4)探究带火星的木条在不同体积分数氧气中的复燃情况,部分实验数据记录如下表所示。已知空气中氧气的体积占1/5。
氧气体积分数/% | 30 | 40 | 60 | 70 |
带火星的木条 | 不变 | 稍亮 | 复燃 | 复燃 |
在集气瓶中注入占其容器50%的水(如图F所示),用排水法收集完氧气后,集气瓶内氧气的体积分数是__________,将带火星的木条伸入该集气瓶中,推测实验现象为______。
【题目】为探究盐酸的化学性质,某化学小组做了如下实验:
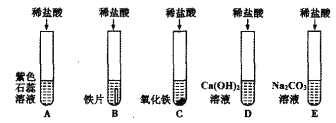
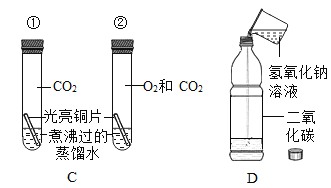
(1)A试管中的实验现象为______________,C试管中所发生反应的化学方程式为____________。
(2)将反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行探究。
(提出问题)滤液中溶质的成分是什么?
(作出猜想)猜想:NaCl
猜想二:NaCl和CaCl2
猜想三:______________
猜想四:NaCl、Ca(OH)2和HCl
(设计实验)请完成实验报告。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量的碳酸钠溶液。 | _________ | 猜想二不成立 |
取少量滤液于试管中, 滴加_______(填名称)。 | _________ | 猜想三成立 |
(迁移拓展)稀盐酸、稀硫酸有一些相似的化学性质,是因为在不同的酸溶液中都含有__________。