题目内容
【题目】有一包固体粉末,可能含有铜、氧化铁、氯化钠、硫酸钠、硫酸铜中的一种或几种,为确定其成分,进行了如下实验,现象如图所示(部分生成物未标出,假设各步都恰好完全反应):
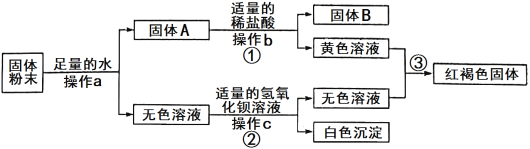
根据实验过程中的现象判断:
(1)操作a、b、c相同,其名称是__________。
(2)固体B的成分是________(填化学式),写出反应③的化学方程式:______________________。
(3)原固体粉末的成分可能有_______种情况。
【答案】过滤 Cu FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl 两(或2)
【解析】
根据题意判断,操作①加入稀盐酸后产生黄色溶液,并且③反应后生成红褐色固体,可判断红褐色固体为氢氧化铁,那么黄色溶液为氯化铁溶液;经过②反应和c操作,生成的无色溶液必然含![]() ,并且可分析c操作为过滤,根据题中提供物质,产生的白色沉淀必然为硫酸钡,又因为生成的碱性溶液中并无沉淀,那生成的无色溶液为氢氧化钠溶液,则反应物无色溶液为硫酸钠;固体粉末加入足量的水经过操作a后,分离出固体A和无色溶液,可知a操作为过滤;固体A和稀盐酸溶液反反应后经过操作b,分离出黄色溶液和固体B,可知b操作为过滤,同时因为所提供的固体中不和稀盐酸反应的只有铜,故固体B为铜。
,并且可分析c操作为过滤,根据题中提供物质,产生的白色沉淀必然为硫酸钡,又因为生成的碱性溶液中并无沉淀,那生成的无色溶液为氢氧化钠溶液,则反应物无色溶液为硫酸钠;固体粉末加入足量的水经过操作a后,分离出固体A和无色溶液,可知a操作为过滤;固体A和稀盐酸溶液反反应后经过操作b,分离出黄色溶液和固体B,可知b操作为过滤,同时因为所提供的固体中不和稀盐酸反应的只有铜,故固体B为铜。
(1)根据以上分析,可知a、b、c操作为过滤,故填过滤;
(2)根据以上分析,固体B为铜,故填![]() ;根据以上分析,该反映为氯化铁和氢氧化钠反应产生氢氧化铁絮状沉淀和氯化钠溶液,故填
;根据以上分析,该反映为氯化铁和氢氧化钠反应产生氢氧化铁絮状沉淀和氯化钠溶液,故填![]() ;
;
(3)根据以上分析,原固体粉末必然有氧化铁和铜,因操作a后产生的是无色溶液,说明不可能有硫酸铜,那么根据产生的硫酸钡沉淀判断,溶液中必然含有硫酸钠,最后可判断固体粉末中比如按含有铜、氧化铁、硫酸钠,可能含有氯化钠,故填两(或2)。