电离常数能用来计算弱酸溶液中的H+的浓度及比较弱酸酸性相对强弱。
例如,醋酸,碳酸和硼酸298K时的电离常数分别是1.75×10-5,4.4×10-7 (第一步电离)和5.8×10-10。由此可知,醋酸,碳酸和硼酸的酸性依次减弱。
1.一元弱酸和弱碱的电离平衡常数
如:CH3COOH 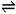 CH3COO- + H+ 则Ka=
CH3COO- + H+ 则Ka=
NH3·H2O 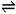 NH4+
+OH-
则Kb=
NH4+
+OH-
则Kb=
注:①K只与 有关,不随浓度改变而改变。
②在一定的温度下,K越大,离子浓度 ,表示该弱电解质越 电离。所以可以用Ka或Kb的大小判断弱酸或弱碱的相对强弱。
⒉多元弱酸(碱)分步电离,酸(碱)性主要由第一步电离决定。
如H3PO4的电离:H3PO4
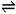 H+ + H2PO4- K1
H+ + H2PO4- K1
H2PO4-
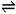 H+ + HPO42- K2
H+ + HPO42- K2
HPO42- 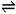 H+ + PO43- K3
注:K1>K2>K3
H+ + PO43- K3
注:K1>K2>K3
注:①K越大,离子浓度越大,表示该弱电解质越易电离。
②多元弱酸(碱)分步电离,酸(碱)性主要由第一步电离决定。
[例1]( ) 在1升浓度为c摩/升的弱酸HA溶液中,HA、H+和A-的物质的量之和为nc摩,则HA的电离度是 (A)n×100% (B)n×100%/2 (C)(n-1)×100% (D)n%
[例2](1)相同物质的量浓度、相同体积的HCl与CH3COOH的比较
|
|
HCl |
CH3COOH |
|
C(H+) |
|
|
|
中和酸所用NaOH的物质的量 |
|
|
|
与过量Zn反应产生H2的体积 |
|
|
|
与Zn反应的起始反应速率 |
|
|
(2) 相同C(H+)、相同体积的HCl与CH3COOH的比较
|
|
HCl |
CH3COOH |
|
|
酸的浓度 |
|
|
|
|
中和所用NaOH的物质的量 |
|
|
|
|
与过量Zn反应产生H2的体积 |
|
|
|
|
与Zn反应 |
起始反应速率 |
|
|
|
反应过程速率 |
|
|
[课堂反馈]
3.弱电解质电离平衡的移动
⑴弱电解质的电离平衡符合勒夏特列原理
⑵影响弱电解质电离平衡的因素有:
① 温度:
② 浓度:
③ 同离子反应:
④ 加入能反应的物质。
[思考]0.1mol/L 的醋酸中存在:CH3COOH CH3COO- + H+
CH3COO- + H+
|
|
平衡移动 |
H+数目 |
C(H+) |
C(CH3COO-) |
Ka |
电离程度 |
导电能力 |
|
NaOH(s) |
|
|
|
|
|
|
|
|
HCl(g) |
|
|
|
|
|
|
|
|
NaAc(s) |
|
|
|
|
|
|
|
|
镁粉 |
|
|
|
|
|
|
|
|
加热 |
|
|
|
|
|
|
|
|
冰醋酸 |
|
|
|
|
|
|
|
|
水 |
|
|
|
|
|
|
|

 H2A H++HA-, HA- H++A2-,已知相同浓度时的电高度a(H2A)>d(HA-),设有下列四种溶液:
A. 0.01mol/L的H2A溶液
B.0.01mol/L的NaHA溶液
C.0.01mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液
D.0.02mol/L的NaOH与0.O2 mol/L的NaHA溶液等体积混合液
据此,填写下列空白(填代号)
(1)[H+]最大的是______________________,最小的是___________________.
(2)[H2A]最大的是______________________,最小的是___________________.
(3)[A2-]最大的是______________________,最小的是___________________.
H2A H++HA-, HA- H++A2-,已知相同浓度时的电高度a(H2A)>d(HA-),设有下列四种溶液:
A. 0.01mol/L的H2A溶液
B.0.01mol/L的NaHA溶液
C.0.01mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液
D.0.02mol/L的NaOH与0.O2 mol/L的NaHA溶液等体积混合液
据此,填写下列空白(填代号)
(1)[H+]最大的是______________________,最小的是___________________.
(2)[H2A]最大的是______________________,最小的是___________________.
(3)[A2-]最大的是______________________,最小的是___________________.