网址:http://m.1010jiajiao.com/timu_id_4382806[举报]
(14分)I.已知:C(s)+H2O(g) CO(g)+H2(g) ΔH
CO(g)+H2(g) ΔH
一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100 kPa | 4.56 | 5.14 | 5.87 | 6.30 | 7.24 | 8.16 | 8.18 | 8.20 | 8.20 |
(1)下列哪些选项可以说明该可逆反应已达平衡状态 。
A.混合气体的密度不再发生改变 B.消耗1 mol H2O(g)的同时生成1 mol H2
C.ΔH不变 D.v正(CO) = v逆(H2)
(2)由总压强P和起始压强P0表示反应体系的总物质的量n总,n总=____ mol;由表中数据计算反应达平衡时,反应物H2O(g)的转化率α =_____(精确到小数点后第二位)。
Ⅱ.硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:xSO2 (g)+2xCO(g)=2xCO2 (g)+Sx (s) ΔH=ax kJ/mol ①
2xCOS(g)+xSO2 (g)=2xCO2 (g)+3Sx (s) ΔH=bx kJ/mol。 ②
则反应COS(g)生成CO(g)、Sx (s)的热化学方程式是 。
(2)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS?、S2?的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。试分析:
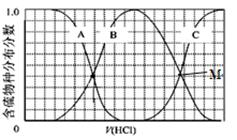
①B曲线代表 分数变化(用微粒符号表示);滴加过程中,溶液中一定成立:
c(Na+)= 。
②M点,溶液中主要涉及的离子方程式 。 查看习题详情和答案>>

(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+
| 1 |
| x |
2COS(g)+SO2(g)=2CO2(g)+
| 3 |
| x |
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料.已知As2S3和HNO3有如下反应:
As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,当生成H3AsO4的物质的量为0.6mol反应中转移电子的数目为
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中H2S、HS-、S2-的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图1所示(忽略滴加过程H2S气体的逸出).
①B表示
②滴加过程中,溶液中微粒浓度大小关系,正确的是
a.c(Na+)=c(H2S)+c(HS-)+2c(S2-)
b.2c(Na+)=c(H2S)+c(HS-)+c(S2-)
c.c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下所示:

①写出反应器中发生反应的化学方程式是
②电渗析装置如图2所示,写出阳极的电极反应式
硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g)? △H= + 571.2 kJ?mol—1
BaS(s)= Ba(s)+S(s)? △H= +460 kJ?mol—1
已知:2C(s)+O2(g)=2CO(g)? △H= -221 kJ?mol—1
则:Ba(s)+S(s)+2O2(g)=BaSO4(s)? △H= ? ? 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:
As2S3+10H++ 10NO3-=2H3AsO4+3S+10NO2↑+ 2H2O
当反应中转移电子的数目为2mol时,生成H3AsO4的物质的量为?? 。
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS—、S2—)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
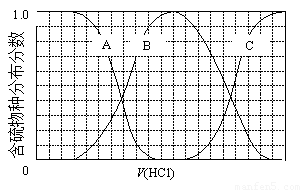
①含硫物种B表示???? 。在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为 ? (填字母)。
a.c(Na+)= c(H2S)+c(HS—)+2c(S2—)
b.2c(Na+)=c(H2S)+c(HS—)+c(S2—)
c.c(Na+)=3[c(H2S)+c(HS—)+c(S2—)]
②NaHS溶液呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是 ? (用离子方程式表示)。
(4)硫的有机物(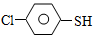 )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。
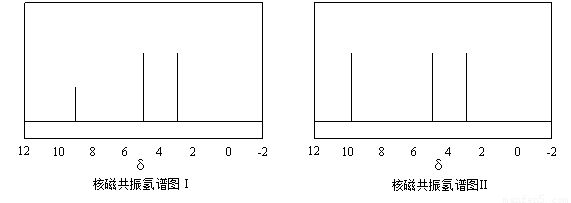
 及X的核磁共振氢谱如下图,其中???? (填“Ⅰ”或“Ⅱ”)为
及X的核磁共振氢谱如下图,其中???? (填“Ⅰ”或“Ⅱ”)为 的核磁共振氢谱图。写出X的结构简式:???? 。
的核磁共振氢谱图。写出X的结构简式:???? 。
查看习题详情和答案>>
硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g) △H=" +" 571.2 kJ?mol—1
BaS(s)= Ba(s)+S(s) △H=" +460" kJ?mol—1
已知:2C(s)+O2(g)=2CO(g) △H=" -221" kJ?mol—1
则:Ba(s)+S(s)+2O2(g)=BaSO4(s) △H= 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:
As2S3+10H++ 10NO3-=2H3AsO4+3S+10NO2↑+ 2H2O
当反应中转移电子的数目为2mol时,生成H3AsO4的物质的量为 。
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS—、S2—)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。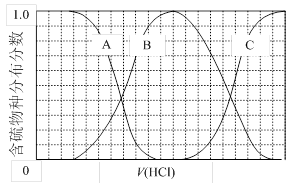
①含硫物种B表示 。在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为 (填字母)。
a.c(Na+)= c(H2S)+c(HS—)+2c(S2—)
b.2c(Na+)=c(H2S)+c(HS—)+c(S2—)
c.c(Na+)=3[c(H2S)+c(HS—)+c(S2—)]
②NaHS溶液呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是 (用离子方程式表示)。
(4)硫的有机物(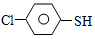 )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。 及X的核磁共振氢谱如下图,其中 (填“Ⅰ”或“Ⅱ”)为
及X的核磁共振氢谱如下图,其中 (填“Ⅰ”或“Ⅱ”)为 的核磁共振氢谱图。写出X的结构简式: 。
的核磁共振氢谱图。写出X的结构简式: 。