6、科学工作者为心脏病人设计的心脏起搏器的电池是以Pt和Zn为电极材料,依靠人体内液体中含有一定浓度的溶解氧、H+和Zn2+进行工作,回答下列问题
(1)负极材料是______ 电极反应式是____________________
(2)正极材料是______ 电极反应式是___________________
[课后作业]案例分析:在伦敦的上流社会,有一位贵族夫人格林太太,幼年时因蛀牙补过一颗不锈钢的假牙。不料后来,她又因为车祸掉了一颗牙,为了显示其富有,她装了一颗黄金假牙。自此以后,她就经常出现头痛、失眠心情烦燥等症状。更奇怪的是,众多的医学家为她检查后,都找不到病因是什么。这位夫人整日感到精神萎靡,找遍各大医院会诊也不见效果。格林太太的病因到底是什么呢?请同学根据本节的知识和我们生物学上的常识进行一下诊断。
教 案
|
课题:第二章 第二节 化学能与电能(二) |
授课班级 |
|
||||
|
课 时 |
|
|||||
|
教 学 目 的 |
知识 与 技能 |
在获得原电池概念和组成条件的基础上,能设计出一些原电池实验,学习实验研究的方法 |
||||
|
过程 与 方法 |
1、 在探究设计原电池实验的过程中,学会运用观察、实验、查阅资料等多种手段获取信息,并运用比较、分类、归纳、概括等方法对信息进行加工 2、 能对自己的化学学习过程进行计划、反思、评价和调控,提高自主学习化学的能力 |
|||||
|
情感 态度 价值观 |
1、有参与化学科技活动的热情,有将原电池知识应用于生产、生活实践的意识,能够对与化学有关的社会和生活问题作出合理的判断 2、了解原电池对个人生活和社会发展的贡献,关注能源问题,逐步形成可持续发展的思想 |
|||||
|
重 点 |
在实验探究的基础上认识原电池的组成及应用 |
|||||
|
难 点 |
对研究成果以及学习过程和结果的评价和反思 |
|||||
|
知 识 结 构 与 板 书 设 计 |
知识拓展------原电池的应用 ①制作化学电源 ②加快反应速率: ③判断金属活动性的强弱 ④揭示钢铁腐蚀的原因及防止钢铁的腐蚀。 二、发展中的化学电源(chemical power source) 1.干电池( dry cell) 负极(锌筒):Zn -2e-= Zn2+; 正极(石墨):正极:2NH4++2e-=2NH3+H2 电池的总反应式为:Zn +2NH4+= Zn2++ 2NH3+H2 副反应:副反应:H2+2MnO2=Mn2O3+H2O 4NH3+Zn2+=[Zn(NH3)4]2+ 2、充电电池 (1) 铅蓄电池(storage battery) 负极:Pb-2e-+SO42-=PbSO4 正极:PbO2+2e-+4H++SO42-=PbSO4+2H2O 蓄电池充电和放电的总化学方程式为:Pb+PbO2+2H2SO4 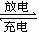 2PbSO4+2H2O 2PbSO4+2H2O(2)镍氢电池 负极:H2 +2OH- -2e-= 2H2O 正极:2NiO(OH) +2H2O +2e- = 2Ni(OH)2 +2OH- 放电总反应式:H2 + 2NiO(OH) = 2Ni(OH)2 (3)碱性蓄电池 1银锌电池: 负极:Zn+2OH--2e-=ZnO+H2O 正极:Ag2O+H2O+2e-=2Ag+2OH- 银锌电池充电和放电的总化学方程式为:Zn+Ag2O+H2O 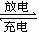 2Ag+Zn(OH)2 2Ag+Zn(OH)22 镉镍电池: 负极:Cd+2OH--2e-=Cd(OH)2 正极:2NiO(OH)+2e-+2H2O=2Ni(OH)2+2OH- 镉镍电池充电和放电的总化学方程式为: 2NiO(OH)+Cd+2H2O 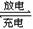 2Ni(OH)2+Cd(OH)2 2Ni(OH)2+Cd(OH)2(4) 锂电池 负极:Li - e- = Li+ 正极:MnO2 + e- = MnO2- 总反应式:Li + MnO2 = LiMnO2 3.燃料电池(fuel cell) (1) 氢氧燃料电池 (碱性)电极反应:负极:2H2+4OH--2e-=4H2O 正极:O2+2H2O+2e-=4OH- 电池的总反应为:2H2 + O2 = 2H2O 若电解质溶液为稀H2SO4 负极:2H2 -4e-=4H+ 正极:O2+ 4H+ + 4e-= 2H2O 放电总反应式: 2H2 + O2 = 2H2O (2) 甲烷氧气燃料电池 负极:CH4+10OH--8e-=CO32-+7H2O 正极:2O2+4H2O+8e-=8OH- 电池的总反应式为:CH4+2O2+2KOH=K2CO3+3H2O |
|||||
|
教学过程 |
||||||
|
教学步骤、内容 |
教学方法、手段、师生活动 |
|||||
|
[知识回顾]1、原电池的原理 2、简单的原电池的正负极和电子流向如何? [过]上节课我们重点学习了原电池的原理和构成条件,那么原电池的原理又是如何应用在我们的生产生活领域上的呢? [板书]知识拓展------原电池的应用 ①制作化学电源 ②加快反应速率: [讲]例如,实验室制H2 时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。 [板书]③判断金属活动性的强弱 ④揭示钢铁腐蚀的原因及防止钢铁的腐蚀。 [讲]钢铁中含有碳,可与Fe组成原电池,发生原电池反应而使钢铁遭到腐蚀 [讲]有一位非常喜欢赶时髦的富商决定建造一艘海上游艇,为了使游艇奢侈豪华,他不惜重金让造船师用昂贵、漂亮、对海水有很强抗腐蚀能力的镍铜合金将船底包起来,由于这种合金的金属强度不够大,造船师又不得不用特种钢来制造游艇的许多零件。在一片赞美声中,游艇缓缓驶进了大海,畅游于碧海波涛中。可是未过几周,这艘游艇底部变得千疮百孔,过早结束了它的使命。你能解释其中的原因吗?  [引言]人们应用原电池原理,制作了多种电池,如干电池、蓄电池、充电电池、高能电池等,以满足不同需要。我们课我们具体来学习几种利用化学能转变为电能的化学电源。 [板书] 二、发展中的化学电源(chemical power source) [讲]最古老的电池 -- 巴格达电池 1936年6月,伊拉克考古学家在巴格达城郊,发现了大量公元前二百多年属于波斯王朝时代的文物,其中包括一些奇怪的陶制器皿和生锈的铜管、铁棒。陶制器皿有点像花瓶,高15厘米,呈淡黄色,瓶里装满了沥青,沥青之中有个铀管,直径2.6厘米,高9厘米,铀管中又有一层沥青,并有一根锈迹斑斑的铁棒。 [讲]上述原电池的结构较简单,携带也不方便,当今的电池工业已能制造出各种各样的实用电池。实用电池一般应具有的特点是:能产生稳定而具有较高电压的电流:安全、耐用且便于携带;能够适用于特殊用途;便于回收处理,不污染环境或对环境产生较小的影响,下面我们来简单介绍几种常见电池和新型电池。 [板书] 1.干电池( dry cell) [讲]干电池是用锌制圆筒型外壳作负极,位于中央的顶盖有铜的石墨作正极,在石墨周围填充NH4Cl和淀粉糊作电解质,还填有MnO2和炭黑(Zn-Mn电池) [板书]负极(锌筒):Zn -2e-= Zn2+; 正极(石墨):正极:2NH4++2e-=2NH3+H2 电池的总反应式为:Zn +2NH4+= Zn2++ 2NH3+H2 副反应:副反应:H2+2MnO2=Mn2O3+H2O 4NH3+Zn2+=[Zn(NH3)4]2+ [讲]淀粉糊的作用是提高阴、阳离子在两极的析出速率。ZnCl2的作用是吸收NH3。MnO2作用是吸收正极放出的H2生成MnO(OH) ,从而消除电极正极H2的集结现象,防止产生极化。干电池是一次性电池,放电后不能再使用,内部氧化还原反应不可逆。为提高使用寿命,用KOH代替NH4Cl来提高性能。 干电池的主要用途是录音机、闪光灯、手电筒、电动玩具、袖珍电视机以及电极、空调摇控器等。 [过]充电电池又称二次电池 。可充电电池是两极都参加反应的电池。这是一种发展较快的原电池,如铅蓄电池、银锌电池、(纽扣电池)、锂电池、爱迪生蓄电池等,它们的负极是较活泼的金属,正极一般是金属氧化物。放电时,负极被氧化。正极材料的氧化物被还原,充电时的电极反应与放电时相反。 [板书]2、充电电池 (1) 铅蓄电池(storage battery) [讲]铅蓄电池可放电亦可充电,它是用硬橡胶和透明塑料制成长方形外壳,在正极板上有一层棕褐色的PbO2,负极是海棉状的金属铅,两极均浸入硫酸溶液中,且两极间用橡胶或微孔塑料隔开。 [板书]负极:Pb-2e-+SO42-=PbSO4 正极:PbO2+2e-+4H++SO42-=PbSO4+2H2O 蓄电池充电和放电的总化学方程式为: Pb+PbO2+2H2SO4 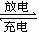 2PbSO4+2H2O 2PbSO4+2H2O[讲]当放电进行到硫酸的浓度降低,溶液的密度达到1.18g/cm3时应停止使用,需充电,充电时起电解池的作用。 [思考与交流]铅蓄电池在放电前后电解质溶液和电极分别有哪些变化?这对电池的继续工作会带来哪些影响? 电解质溶液的浓度有所下降,同时电极上都附着一层难溶物PbSO4 使电池的电压降低,电压不稳定,欲使其恢复,就要对其进行充电 [板书](2)镍氢电池 负极:H2 +2OH- -2e-= 2H2O 正极:2NiO(OH) +2H2O +2e- = 2Ni(OH)2 +2OH- 放电总反应式:H2 + 2NiO(OH) = 2Ni(OH)2 [讲]1970-1975开发了先进的银锌、镍镉电池技术。1975-1983美国海军生产潜水艇用银锌电池。1979-1987美国国家能源部发展电动车用的镍锌电池。1998-1992美国海军发展世界上最大的镍镉电池用于核潜水 [板书](3)碱性蓄电池 1银锌电池: 负极:Zn+2OH--2e-=ZnO+H2O 正极:Ag2O+H2O+2e-=2Ag+2OH- 银锌电池充电和放电的总化学方程式为: Zn+Ag2O+H2O 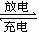 2Ag+Zn(OH)2 2Ag+Zn(OH)2[讲]正极壳填充Ag2O和石墨,负极盖填充锌汞合金,电解质溶液KOH。 [板书] 2 镉镍电池: 负极:Cd+2OH--2e-=Cd(OH)2 正极:2NiO(OH)+2e-+2H2O=2Ni(OH)2+2OH- 镉镍电池充电和放电的总化学方程式为: 2NiO(OH)+Cd+2H2O 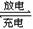 2Ni(OH)2+Cd(OH)2 2Ni(OH)2+Cd(OH)2[讲] [讲解]负极材料:Cd,正极材料:涂有NiO2,电解质:KOH溶液。镍镉电池寿命较蓄电池长,但镉是致癌物,镍镉污染环境。 [讲]还有一种广泛用于笔记本电脑、移动电话、摄像机的锂离子电池,其寿命较长,被称为绿色电池 [板书](4) 锂电池 负极:Li - e- = Li+ 正极:MnO2 + e- = MnO2- 总反应式:Li + MnO2 = LiMnO2 [讲]优点:质量轻、容量大、放电时间长。锂电池是一种高能电池,锂作为负极,技术含量高,有质量轻、体积小、电压高、工作效率高和寿命长等优点。常用于电脑笔记本、手机、照相机、心脏起博器、火箭、导弹等的动力电源。 [讲]还有一种新型高效氢氧燃料电池,主要用于航天领域,它的电极一般为活化电极,具有很强的催化活性,如铂电极、活性炭电极等,电解质溶液为40%KOH溶液。 [板书]3.燃料电池(fuel cell) (1) 氢氧燃料电池 (碱性)电极反应:负极:2H2+4OH--2e-=4H2O 正极:O2+2H2O+2e-=4OH- 电池的总反应为:2H2 + O2 = 2H2O [讲]该电池的特点是能量转化率高,可达70%以上,且其燃烧的产物为水,因此不污染环境。 [板书] 若电解质溶液为稀H2SO4 负极:2H2 -4e-=4H+ 正极:O2+ 4H+ + 4e-= 2H2O 放电总反应式: 2H2 + O2 = 2H2O [讲]新型燃料电池:该电池用金属铂片插入KOH溶液中作电极,又在两极上分别通甲烷和氧气。 [板书](2) 甲烷氧气燃料电池 负极:CH4+10OH--8e-=CO32-+7H2O 正极:2O2+4H2O+8e-=8OH- 电池的总反应式为:CH4+2O2+2KOH=K2CO3+3H2O |
|
|||||
|
教学回顾: |
||||||





