10.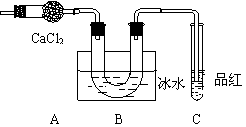 某学生设计如下实验,用于检验硫酸亚铁晶体(FeSO4·nH2O)分解产物并测定其结晶水的n值,步骤如下:
某学生设计如下实验,用于检验硫酸亚铁晶体(FeSO4·nH2O)分解产物并测定其结晶水的n值,步骤如下:
① 在质量为m1g的某容器中放入适量的
已研碎的硫酸亚铁晶体,再称量为m2g;
① 在隔绝空气的条件下,将晶体强热,
并将气态产物通过如下装置(设每步吸收均
是完全的),直至晶体全部变为红棕色粉末
为止,发现U形管底部有无色晶体析出,
品红溶液褪色。
③ 将红色粉末冷却至温室,称量(连容器)为m3g
④ 重复加热、冷却、称量、直至合格为止
回答下列问题:
(1) 第①步实验中盛放晶体的容器是(从下列选出)
A.坩埚 B. 蒸发皿 C. 烧瓶 D. 石英试管
(2) 第③步实验应如何冷却? ;
(3) 第④步实验称量合格的标准是 ;
(4) 求n值的计算式是 ;
(5) U形管中的晶体可能是什么物质?如何检验? ;
(6) 根据实验结果,写出FeSO4·nH2O分解化学方程式(化学计量数可用n表示)
第4讲 物质的检验、分离和提纯
例1、(1)pH试纸 (2)NaOH (3)HCl (4)蒸馏水
例2、D
例3从浓硫酸中取出铜片,用水洗干净后,放入稀硫酸中,如溶液呈蓝色,说明铜发生了钝化,否则没有钝化
例4(1)合理
(2)用磁铁吸引,若能吸附,说明有铁生成
(3)NaOH溶液 取少量样品放入试管,加入NaOH溶液, 有气泡产生,说明该熔融物中有铝。
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
例5(1)Br2;Fe3+
(2)乙
|
实验方案 |
选用试剂(填代号) |
实验现象 |
|
方案一 |
C |
有机层无色 |
|
方案二 |
D |
溶液变红 |
(3)Fe2+;不可以,因为Br2和Fe3+都能把I-氧化成I2
课堂练习
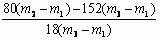
 (6) 2FeSO4·nH2O Fe2O3
+ SO3↑+ SO2↑+ 2nH2O
(6) 2FeSO4·nH2O Fe2O3
+ SO3↑+ SO2↑+ 2nH2O