网址:http://m.1010jiajiao.com/timu_id_3964801[举报]
(NH4)2SO4+FeSO4+6H2O![]() (NH4)2Fe(SO4)2·6H2O。
(NH4)2Fe(SO4)2·6H2O。
某研究性学习小组设计的在实验室用废铁屑制备莫尔盐的步骤如下:
①将废铁屑放入10%的Na2CO3溶液中煮沸除油污,冷却,洗涤,倾析得铁屑;
②将处理过的铁屑放入过量的3 mol·L-1 H2SO4溶液中,控温在50 —
③将一定量硫酸铵加入到硫酸亚铁溶液中,使其完全溶解;
④从溶液中分离出莫尔盐晶体。
试回答:
(1)步骤②中存在设计缺陷,应改进为_________________,改进的目的是(用离子方程式表示)_________________。
(2)步骤④从溶液中分离出莫尔盐晶体的实验操作包括________________________。
(3)请设计实验,检验莫尔盐晶体中是否含有Fe3+。__________________________。
查看习题详情和答案>>①取少量晶体放在试管内,用酒精灯加热试管口有液体产生,说明晶体中含有水;
②将加热后剩余的晶体溶解于水,加入用盐酸酸化过的氯化钡溶液,有白色沉淀生成,说明晶体中含有SO42-;
③滤去白色沉淀,向滤液中加入过量的浓氢氧化钠溶液,加热,有能使红色石蕊试纸变蓝的气体产生,说明晶体中含有NH4+;
④向步骤③的剩余液体中加入KSCN溶液,无明显变化,再加入少量氯水,溶液变红色,说明晶体中含有亚铁离子,其中不能达到实验目的的是
B.①④
C.③④
D.④
(14分,每空2分)
硫酸亚铁容易被氧化,而硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀) FeSO4+H2↑
FeSO4+(NH4)2SO4+6H2O
(NH4)2SO4·FeSO4·6H2O
步骤l:在盛有适量铁屑的锥形瓶里加入某种试剂除去油污,加热,充分反应后过滤、
洗涤、干燥、称量,铁屑质量为 。
。
步骤2:将处理过的铁屑加入到一定量的稀H2SO4中,加热至50℃—80℃充分反应,
趁热过滤并用少量热水洗涤,滤液及洗涤液都转移至蒸发皿中。滤渣干燥后称重,剩余铁屑质量为 。
。
步骤3:准确称取所需质量的硫酸铵晶体加入“步骤2”的蒸发皿中,搅拌使之溶解,
缓缓加热一段时间,将其冷却结晶、过滤。用无水乙醇洗涤晶体并自然干燥,称量所得晶体质量为 。
。
回答下列问题:
(1)能够用于除去铁屑表面油污的试剂是 (填字母)。
A.纯碱溶液 B.烧碱溶液 C.明矾溶液 D.稀硫酸
(2)步骤2中趁热过滤的目的是 。
(3)硫酸亚铁在潮湿的空气中易被氧化生成一种物质(碱式硫酸铁),该反应的化学方程式为 。
(4)铁屑表面常有少量的铁锈(Fe2O3· H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答)
。[来源:Zxxk.Com]
H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答)
。[来源:Zxxk.Com]
(5)若忽略铁锈的影响,上述实验中硫酸亚铁铵晶体的产率为 。
(6)请设计一个简单的实验,检验硫酸亚铁铵晶体中含有结晶水(简述实验操作、现象和结论) 。
查看习题详情和答案>>
(14分,每空2分)硫酸亚铁容易被氧化,而硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀) FeSO4+H2↑
FeSO4+(NH4)2SO4+6H2O (NH4)2SO4·FeSO4·6H2O
步骤l:在盛有适量铁屑的锥形瓶里加入某种试剂除去油污,加热,充分反应后过滤、
洗涤、干燥、称量,铁屑质量为![]() 。
。
步骤2:将处理过的铁屑加入到一定量的稀H2SO4中,加热至50℃—80℃充分反应,
趁热过滤并用少量热水洗涤,滤液及洗涤液都转移至蒸发皿中。滤渣干燥后称重,剩余铁屑质量为![]() 。
。
步骤3:准确称取所需质量的硫酸铵晶体加入“步骤2”的蒸发皿中,搅拌使之溶解,
缓缓加热一段时间,将其冷却结晶、过滤。用无水乙醇洗涤晶体并自然干燥,称量所得晶体质量为![]() 。
。
回答下列问题:
(1)能够用于除去铁屑表面油污的试剂是 (填字母)。
A.纯碱溶液 B.烧碱溶液 C.明矾溶液 D.稀硫酸
(2)步骤2中趁热过滤的目的是 。
(3)硫酸亚铁在潮湿的空气中易被氧化生成一种物质(碱式硫酸铁),该反应的化学方程式为 。
(4)铁屑表面常有少量的铁锈(Fe2O3·![]() H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。
H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。
(5)若忽略铁锈的影响,上述实验中硫酸亚铁铵晶体的产率为 。
(6)请设计一个简单的实验,检验硫酸亚铁铵晶体中含有结晶水(简述实验操作、现象和结论) 。
查看习题详情和答案>>
(14分,每空2分) 硫酸亚铁容易被氧化,而硫酸亚铁 铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀)
铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀) FeSO4+H2↑
FeSO4+(NH4)2SO4+6H2O (NH4)2SO4·FeSO4·6H2 O
O
步骤l:在盛有适量铁屑的锥形瓶里加入某种试剂除去油污,加热,充分反应后过滤、
洗涤、干燥、称量,铁屑质量为 。
。
步骤2:将处理过的铁屑加入到一定量的稀H2SO4中,加热至50℃—80℃充分反应,
趁热过滤并用少量热水洗涤,滤液及洗涤液都转移至蒸发皿中。滤渣干燥后称重,剩余铁屑质量为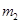 。
。
步骤3:准确称取所需质量的硫酸铵晶体加入“步骤2”的蒸发皿中,搅拌 使之溶解,
使之溶解,
缓缓加热一段时间,将其冷却结晶、过滤。用无水乙醇洗涤晶体并自然干燥,称量所 得晶体质量为
得晶体质量为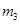 。
。
回答下列问题:
(1)能够用于除去铁屑表面油污的试剂是 (填字母)。
| A.纯碱溶液 | B.烧碱溶液 | C.明矾溶液 | D.稀硫酸 |
(3)硫酸亚铁在潮湿的空气中易被氧化生成一种物质
 (碱式硫酸铁),该反应的化学方程式为 。
(碱式硫酸铁),该反应的化学方程式为 。(4)铁屑表面常有少量的铁锈(Fe2O3·
 H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。
H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。(5)若忽略铁锈的影响,上述实验中硫酸亚铁铵
 晶体的产率为
晶体的产率为  。
。(6)请设计一个简单的实验,检验硫酸亚铁铵晶体中含有结晶水(简述实验操作、现象和结论) 。 查看习题详情和答案>>