【题目】分别取40mL的0.50mol·L-1盐酸与40mL的0.55mol·L-1NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀NaOH溶液反应的中和热的热化学方程式__。
(2)如图所示,A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其原因是__。
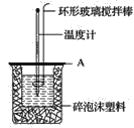
(3)假设盐酸和NaOH溶液的密度都是1g·cm-3,又知中和后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,实验时还需测量的数据有(填字母)__。
A.反应前盐酸溶液的温度
B.反应前盐酸溶液的质量
C.反应前NaOH溶液的温度
D.反应前NaOH溶液的质量
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH | ||
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
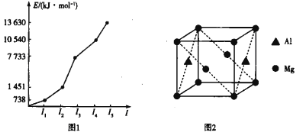
依据该学生的实验数据计算,该实验测得的中和热ΔH=__。
【题目】实验室制备叔丁基苯(![]() )的反应和有关数据如下:
)的反应和有关数据如下:
![]() +ClC(CH3)3
+ClC(CH3)3![]()
![]() +HCl
+HCl
物质 | 相对分子质量 | 密度/gcm-3 | 熔点/℃ | 沸点/℃ | 溶解性 |
AlCl3 | —— | —— | 190 | 易升华 | 遇水极易潮解并产生白色烟雾,微溶于苯 |
苯 | 78 | 0.88 | —— | 80.1 | 难溶于水,易溶于乙醇 |
氯代叔丁烷 | 92.5 | 1.85 | —— | 51.6 | 难溶于水,可溶于苯 |
叔丁基苯 | 134 | 0.87 | —— | 169 | 难溶于水,易溶于苯 |
I.如图是实验室制备无水AlCl3可能需要的装置:
A.  B.
B. 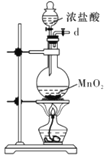 C.
C. 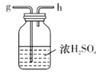 D.
D.  E.
E.  F.
F. 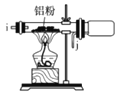
(1)检查B装置气密性的方法是__________。
(2)制备无水AlCl3的装置的合理的连接顺序为________(填小写字母),其中E装置的作用是___________。
(3)实验时应先加热圆底烧瓶再加热硬质玻璃管,其原因是________。
II.如图是实验室制备叔丁基苯的装置(夹持装置略):

在三颈烧瓶中加入50mL的苯和适量的无水AlCl,由恒压漏斗滴加氯代叔丁烷10 mL,一定温度下反应一段时间后,将反应后的混合物洗涤分离,在所得产物中加入少量无水MgSO4固体,静置,过滤,蒸馏得叔丁基苯20 g。
使用恒压漏斗的优点是_________;加入无水MgSO4固体的作用是____________________________________。
(5)洗涤混合物时所用的试剂有如下三种,正确的使用顺序是__________(填序号)
①5%的Na2CO3溶液 ②稀盐酸 ③H2O
(6)本实验中叔丁基苯的产率为______________(保留3位有效数字)