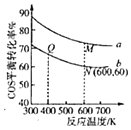
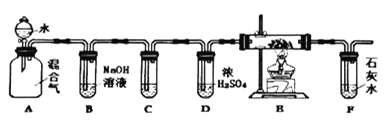
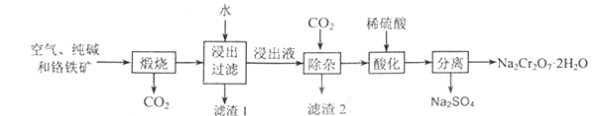
题目内容
【题目】乙炔(C2H2)气体的燃烧热为ΔH=-1299.6kJ·mol-1,分别写出表示乙炔燃烧反应的热化学方程式和表示乙炔燃烧热的热化学方程式____、____。
【答案】2C2H2(g)+ 5O2(g)=4CO2(g)+2H2O(l) ΔH=-2599.2kJ·mol-1 C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l) ΔH=-1299.6kJ·mol-1
O2(g)=2CO2(g)+H2O(l) ΔH=-1299.6kJ·mol-1
【解析】
乙炔的燃烧热(△H)为-1299.6kJ/mol,则1molC2H2(g)完全燃烧生成水和二氧化碳放出1366.8KJ的热量。
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-QkJ·mol-1,由(C2H2)燃烧热为ΔH=-1299.6 kJ·mol-1知Q=2599.2。表示燃烧反应的热化学方程式为2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2599.2 kJ·mol-1。表示燃烧热的热化学方程式中可燃物的化学计量数必为1,则表示燃烧热的热化学方程式为C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l) ΔH=-1299.6 kJ·mol-1,
O2(g)=2CO2(g)+H2O(l) ΔH=-1299.6 kJ·mol-1,
故答案为:2C2H2(g)+ 5O2(g)=4CO2(g)+2H2O(l)ΔH=-2599.2kJ·mol-1;C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l) ΔH=-1299.6kJ·mol-1。
O2(g)=2CO2(g)+H2O(l) ΔH=-1299.6kJ·mol-1。

【题目】现以0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1HCl溶液为例,讨论强碱滴定强酸的情况,通过计算完成下表(已知:lg2=0.3,lg5=0.7。溶液混合时的体积变化忽略不计)。
加入NaOH溶液的体积V/mL | 0.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
剩余盐酸溶液的体积V/mL | 20.00 | 2.00 | 0.20 | 0.02 | 0.00 | / | / | / | / |
过量NaOH溶液的体积V/mL | / | / | / | / | / | 0.02 | 0.20 | 2.00 | 20.00 |
pH | 1.00 | 2.28 | 3.30 | __ | 7.00 | 9.70 | __ | 11.70 | 12.50 |
(1)请利用表的数据绘制滴定曲线_____。
(2)如果初读数和末读数如图所示,滴定液的用量为__mL。