��Ŀ����
����Ŀ���ֱ�ȡ40mL��0.50mol��L-1������40mL��0.55mol��L-1NaOH��Һ�����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ���ش��������⣺
��1��������ϡǿ�ᡢϡǿ�Ӧ����1molˮʱ�ų�57.3kJ��������д����ʾϡ�����ϡNaOH��Һ��Ӧ���к��ȵ��Ȼ�ѧ����ʽ__��
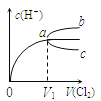
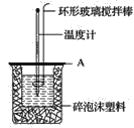
��2����ͼ��ʾ��AΪ��ĭ���ϰ壬����������С�ף��ֱ�����¶ȼƺͻ��β��������������С�ײ��ܿ��ù�����ԭ����__��
��3�����������NaOH��Һ���ܶȶ���1g��cm-3����֪�кͺ�������Һ�ı�����c��4.18J��g-1����-1��Ϊ�˼����к��ȣ�ʵ��ʱ���������������(����ĸ)__��
A����Ӧǰ������Һ���¶�
B����Ӧǰ������Һ������
C����ӦǰNaOH��Һ���¶�
D����ӦǰNaOH��Һ������
E����Ӧ������Һ������¶�
F����Ӧ������Һ������
��4��ijѧ��ʵ���¼�������£�
ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | |
���� | NaOH | ||
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
���ݸ�ѧ����ʵ�����ݼ��㣬��ʵ���õ��к�����H��__��
���𰸡�NaOH(aq)��![]() H2SO4(aq)=
H2SO4(aq)=![]() Na2SO4(aq)��H2O(l) ��H����57.3kJ��mol-1 ��������ɢʧ ACE ��51.8 kJ��mol-1
Na2SO4(aq)��H2O(l) ��H����57.3kJ��mol-1 ��������ɢʧ ACE ��51.8 kJ��mol-1
��������
(1)��������кͷ�Ӧ����1molҺ̬ˮʱ�ų�57.3kJ��������д�Ȼ�ѧ����ʽ��
(2)���ݲⶨ�к��ȹ����б��뾡������������ɢʧ������
(3)�����к��ȼ��㹫ʽQ=cm��T���漰��δ֪���ݽ����жϣ�
(4)�ȸ��ݱ��вⶨ���ݼ�������Һ��Ӧǰ���ƽ���¶Ȳ�ٸ���Q=cm��T�������Ӧ�ų�����������������к��ȡ�
(1)�к�����ָ�ᡢ���ϡ��Һ��ȫ��Ӧ����1 molˮʱ�ķ�Ӧ�ȣ����ʾϡ�����NaOHϡ��Һ�к��ȵ��Ȼ�ѧ����ʽ��ˮ�ļ�����Ϊ1 mol������NaOH(aq)��![]() H2SO4(aq)=
H2SO4(aq)=![]() Na2SO4(aq) ��H2O(l)����H����57.3 kJ��mol��1��
Na2SO4(aq) ��H2O(l)����H����57.3 kJ��mol��1��
�ʴ�Ϊ��NaOH(aq)��![]() H2SO4(aq)=
H2SO4(aq)=![]() Na2SO4(aq) ��H2O(l)����H����57.3 kJ��mol��1��
Na2SO4(aq) ��H2O(l)����H����57.3 kJ��mol��1��
(2)��ĭ���ϰ���������С�ף��ֱ�����¶ȼƺͻ��β����������������С���ù��ᵼ��ɢʧ�϶��������Ӱ��ⶨ�����
�ʴ�Ϊ����������ɢʧ��
(3)��Q��cm��T��֪���ⶨ�к�����Ҫ�ⶨ������Ϊ��Ӧǰ������Һ���¶ȡ���ӦǰNaOH��Һ���¶Ⱥͷ�Ӧ������Һ������¶ȣ�
�ʴ�Ϊ��ACE��
(4)��1��ʵ�������NaOH��Һ��ʼƽ���¶�Ϊ20.05 �棬��Ӧ���¶�Ϊ23.2 �棬��Ӧǰ���¶Ȳ�Ϊ3.15 �棻��2��ʵ�������NaOH��Һ��ʼƽ���¶�Ϊ20.3 �棬��Ӧǰ���¶Ȳ�Ϊ3.1 �棻��3��ʵ�������NaOH��Һ��ʼƽ���¶�Ϊ20.55 �棬��Ӧǰ���¶Ȳ�Ϊ3.05 �棻40 mL��0.50 mol��L��1������40 mL��0.55 mol��L��1NaOH��Һ��������Ϊm��80 mL��1 g��cm��3��80 g��c��4.18 J��g��1������1�����빫ʽQ��cm��T������0.02 mol��ˮ�ų�����Q��4.18 J��g��1������1��80 g��![]() ��1.037 kJ������1 mol��ˮ�ų�����Ϊ1.037 kJ��
��1.037 kJ������1 mol��ˮ�ų�����Ϊ1.037 kJ��![]() ����51.8 kJ��mol��1����ʵ���õ��к�����H����51.8 kJ��mol��1��
����51.8 kJ��mol��1����ʵ���õ��к�����H����51.8 kJ��mol��1��
�ʴ�Ϊ����51.8 kJ��mol-1��

 ������ϵ�д�
������ϵ�д�����Ŀ��ʵ�����Ʊ��嶡����(![]() )�ķ�Ӧ���й��������£�
)�ķ�Ӧ���й��������£�
![]() +ClC(CH3)3
+ClC(CH3)3![]()
![]() +HCl
+HCl
���� | ��Է������� | �ܶ�/gcm-3 | �۵�/�� | �е�/�� | �ܽ��� |
AlCl3 | ���� | ���� | 190 | ������ | ��ˮ���׳��Ⲣ������ɫ���������ڱ� |
�� | 78 | 0.88 | ���� | 80.1 | ������ˮ���������Ҵ� |
�ȴ��嶡�� | 92.5 | 1.85 | ���� | 51.6 | ������ˮ�������ڱ� |
�嶡���� | 134 | 0.87 | ���� | 169 | ������ˮ�������ڱ� |
I.��ͼ��ʵ�����Ʊ���ˮAlCl3������Ҫ��װ�ã�
A.  B.
B.  C.
C.  D.
D.  E.
E.  F.
F. 
(1)���Bװ�������Եķ�����__________��
(2)�Ʊ���ˮAlCl3��װ�õĺ���������˳��Ϊ________(��Сд��ĸ)������Eװ�õ�������___________��
(3)ʵ��ʱӦ�ȼ���Բ����ƿ�ټ���Ӳ�ʲ����ܣ���ԭ����________��
II.��ͼ��ʵ�����Ʊ��嶡������װ��(�г�װ����)��

��������ƿ�м���50mL�ı�����������ˮAlCl���ɺ�ѹ©���μ��ȴ��嶡��10 mL��һ���¶��·�Ӧһ��ʱ�����Ӧ��Ļ����ϴ�ӷ��룬�����ò����м���������ˮMgSO4���壬���ã����ˣ�������嶡����20 g��
ʹ�ú�ѹ©�����ŵ���_________��������ˮMgSO4�����������____________________________________��
(5)ϴ�ӻ����ʱ���õ��Լ����������֣���ȷ��ʹ��˳����__________(�����)
��5%��Na2CO3��Һ ��ϡ���� ��H2O
(6)��ʵ�����嶡�����IJ���Ϊ______________(����3λ��Ч����)