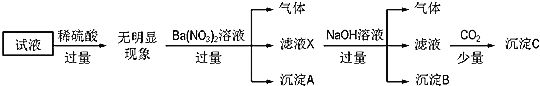
题目内容
【题目】实验室制备叔丁基苯(![]() )的反应和有关数据如下:
)的反应和有关数据如下:
![]() +ClC(CH3)3
+ClC(CH3)3![]()
![]() +HCl
+HCl
物质 | 相对分子质量 | 密度/gcm-3 | 熔点/℃ | 沸点/℃ | 溶解性 |
AlCl3 | —— | —— | 190 | 易升华 | 遇水极易潮解并产生白色烟雾,微溶于苯 |
苯 | 78 | 0.88 | —— | 80.1 | 难溶于水,易溶于乙醇 |
氯代叔丁烷 | 92.5 | 1.85 | —— | 51.6 | 难溶于水,可溶于苯 |
叔丁基苯 | 134 | 0.87 | —— | 169 | 难溶于水,易溶于苯 |
I.如图是实验室制备无水AlCl3可能需要的装置:
A.  B.
B. 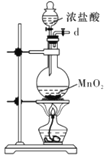 C.
C. 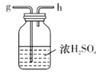 D.
D.  E.
E.  F.
F. 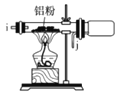
(1)检查B装置气密性的方法是__________。
(2)制备无水AlCl3的装置的合理的连接顺序为________(填小写字母),其中E装置的作用是___________。
(3)实验时应先加热圆底烧瓶再加热硬质玻璃管,其原因是________。
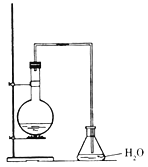
II.如图是实验室制备叔丁基苯的装置(夹持装置略):

在三颈烧瓶中加入50mL的苯和适量的无水AlCl,由恒压漏斗滴加氯代叔丁烷10 mL,一定温度下反应一段时间后,将反应后的混合物洗涤分离,在所得产物中加入少量无水MgSO4固体,静置,过滤,蒸馏得叔丁基苯20 g。
使用恒压漏斗的优点是_________;加入无水MgSO4固体的作用是____________________________________。
(5)洗涤混合物时所用的试剂有如下三种,正确的使用顺序是__________(填序号)
①5%的Na2CO3溶液 ②稀盐酸 ③H2O
(6)本实验中叔丁基苯的产率为______________(保留3位有效数字)
【答案】分液漏斗注入水后,关闭止水夹,打开分液漏斗的活塞使液体流下,一段时间后液体不能继续流下,说明气密性良好 defghijc 防止空气中的水蒸气进入,吸收多余的氯气 若先加热硬质玻璃管,Al先与O2反应,无法制得纯净AlCl3 使液体顺利滴下 干燥 ②①③ 74.6%
【解析】
实验室制备无水AlCl3,需要干燥的氯气与铝在加热条件下反应,题中B用于制备氯气,用D、C装置分别除去HCl、水,用F装置制备氯化铝,避免固体堵塞导管,最后连接E,以吸收空气中的水,且防止氯气污染空气;
Ⅱ.如图是实验室制备叔丁基苯的装置,在三颈烧瓶中加入50 mL的苯和适量的无水AlCl3,由恒压漏斗滴加氯代叔丁烷10mL,恒压漏斗可使液体顺利滴下,产物中加入无水硫酸镁,可起到干燥的作用,反应后混合物中含有氯化铝以及水解生成的氢氧化铝,可加入稀盐酸,然后加入碳酸钠除去盐酸,最后加入水洗涤,以此解答该题。
(1)检查B装置气密性,可利用压强差原理,将分液漏斗注入水后,关闭止水夹,打开分液漏斗的活塞使液体流下,一段时间后液体不能继续流下,说明气密性良好;故答案为:分液漏斗注入水后,关闭止水夹,打开分液漏斗的活塞使液体流下,一段时间后液体不能继续流下,说明气密性良好。
⑵B用于制备氯气,用D、C装置分别除去HCl、水,用F装置制备氯化铝,避免固体堵塞导管,最后连接E,以吸收空气中的水,且防止氯气污染空气,则连接顺序为defghijc;故答案为:defghijc;防止空气中的水蒸气进入,吸收多余的氯气。
(3)实验时应先加热圆底烧瓶再加热硬质玻璃管,原因是若先加热硬质玻璃管,Al先与O2反应,无法制得纯净AlCl3,加热圆底烧瓶,生成的氯气可将装置内的空气排出;故答案为:若先加热硬质玻璃管,Al先与O2反应,无法制得纯净AlCl3。
(4)使用恒压漏斗的优点是使液体顺利滴下,MgSO4固体具有吸水作用,加入无水MgSO4固体可起到干燥的作用;故答案为:使液体顺利滴下;干燥。
(5)反应后混合物中含有氯化铝以及水解生成的氢氧化铝,可加入稀盐酸,然后加入碳酸钠除去盐酸,最后加入水洗涤,则顺序为②①③,故答案为:②①③;
(6)50mL的苯的物质的量为50mL×0.55gmL-1÷78gmol-1=0.35mol,10mL氯代叔丁烷的物质的量为10mL×1.85gmL-1÷ 92.5gmol-1=0.2mol,由方程式可知理论可生成0.2mol叔丁基苯,质量为0.2mol×134gmol-1=26.8g,则产率为20g÷26.8g×100%=74.6%,故答案为:74.6%。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案【题目】分别取40mL的0.50mol·L-1盐酸与40mL的0.55mol·L-1NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀NaOH溶液反应的中和热的热化学方程式__。
(2)如图所示,A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其原因是__。
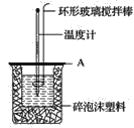
(3)假设盐酸和NaOH溶液的密度都是1g·cm-3,又知中和后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,实验时还需测量的数据有(填字母)__。
A.反应前盐酸溶液的温度
B.反应前盐酸溶液的质量
C.反应前NaOH溶液的温度
D.反应前NaOH溶液的质量
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH | ||
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__。