题目内容
【题目】已知热化学反应方程式:
反应Ⅰ:N2H4(g)![]() N2(g)+2H2(g) ΔH1
N2(g)+2H2(g) ΔH1
反应Ⅱ:N2(g)+3H2(g)![]() 2NH3(g) ΔH2
2NH3(g) ΔH2
(1)ΔH1__ΔH2(填“<”、“>”或“=”)。
(2)7N2H4(g)![]() 8NH3(g)+3N2(g)+2H2(g) ΔH=__(用ΔH1、ΔH2表示)。
8NH3(g)+3N2(g)+2H2(g) ΔH=__(用ΔH1、ΔH2表示)。
【答案】> 7ΔH1+4ΔH2
【解析】
(1)反应Ⅰ是吸热反应,反应Ⅱ是放热反应,前者>0,后者<0;
(2)依据盖斯定律将已知热化学方程式进行叠加得到目标反应方程式,方程式的函数关系同样适用于焓变。
(1)反应Ⅰ是吸热反应,反应Ⅱ是放热反应,前者>0,后者<0,则ΔH1>ΔH2,
故答案为:>;
(2)依据盖斯定律将已知热化学方程式进行叠加得到目标反应方程式,方程式的函数关系同样适用于焓变。目标反应方程式可由(反应Ⅰ×7+反应Ⅱ×4)得到,它们的函数关系同样适用于焓变,则ΔH=7ΔH1+4ΔH2,
故答案为:7ΔH1+4ΔH2。

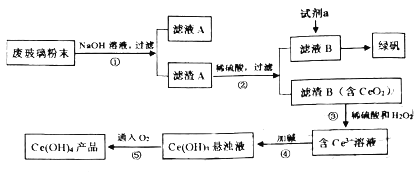
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、 Al2O3、FeO、CaO、SiO2 )为原料,制取醋酸镍的工艺流程图如下:
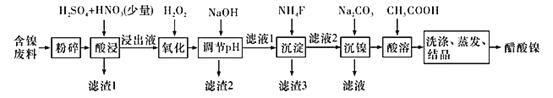
相关离子生成氢氧化物的pH和相关物质的溶解性如表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时的溶解性(H2O) |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
Fe2+ | 5.8 | 8.8 | NiF2 | 可溶 |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.60×10-6 |
(1)粉碎含镍废料的作用是__________。
(2)酸浸过程中,1molNiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:_____________。
(3)写出氧化步骤中加入H2O2发生反应的离子方程式:________。
(4)调节pH除铁、铝步骤中,溶液pH的调节范围是________。
(5)滤渣3主要成分的化学式是_________。
(6)沉镍过程中,若c(Ni2+ )=2.0 mol·L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5 mol·L-1],则需要加入Na2CO3固体的质量最少为___________g(保留1位小数)。
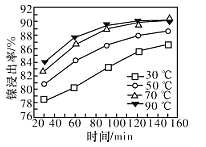
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为______℃、_______min。