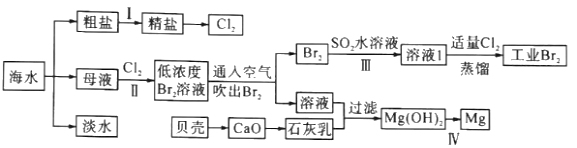
【题目】下图是中学化学中常用于化合物的分离和提纯装置,请根据装置回答问题:
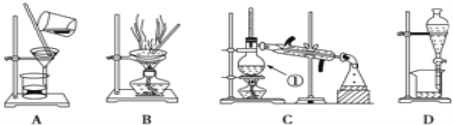
下图是中学化学中常用于化合物的分离和提纯装置,请根据装置回答问题:
(1)装置B中被加热仪器的名称是_____,装置C中①的名称是_________。
(2)某硝酸钠固体中混有少量硫酸钠杂质,现设计一实验方案,既除去杂质,又配成硝酸钠溶液。
实验方案:先将固体溶于蒸馏水配成溶液,选择合适的试剂和操作完成表格中各步实验。
选择试剂 | ① | Na2CO3溶液 | ④ |
实验操作 | ② | ③ | 加热 |
所加入的试剂①可以是_____(填化学式),证明溶液中SO42-已经除尽的操作是__________。加入Na2CO3溶液的目的是__________,所加入的试剂④是____________ (填化学式)。
(3)青蒿素是高效的抗疟疾药,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差。已知:乙醚沸点为35℃。提取青蒿素的主要工艺为:
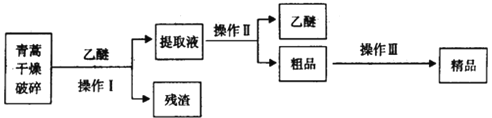
若要在实验室模拟上述工艺,操作I选择的实验操作是_____,操作Ⅱ选择的实验操作是_________。
【题目】三氯化磷(PCl3)是一种基础化工原料使用广泛需求量大。实验室可用白磷与氯气反应制备三氯化磷,实验装置如图所示(夹持装置未画出)。
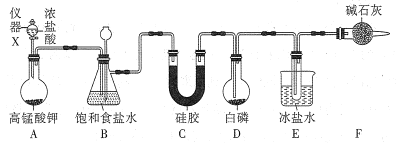
已知:①氯气与白磷反应放出热量(温度高于75℃)。
②PCl3和PCl5遇水强烈反应并产生大量的白雾。
③PCl3和PCl5的物理常数如下:
熔点 | 沸点 | |
PCl3 | -112℃ | 76℃ |
PCl5 | 146℃ | 200℃分解 |
回答下列问题:
(1)仪器X的名称是___;装置A中发生反应的离子方程式为___。
(2)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C或D中是否发生堵塞,若装置C或D中发生堵塞时B中的现象是__。
(3)为防止装置D因局部过热而炸裂,实验开始前应在圆底烧瓶的底部放少量__(填“干沙”或“水”)。
(4)装置E的烧杯中冰盐水的作用是___。
(5)装置F的作用:一是防止空气中水蒸气的进入;二是___。
(6)前期白磷过量生成PCl3,后期氯气过量生成PCl5,从PC13和PCl5的混合物中分离出PCl3的最佳方法是___。
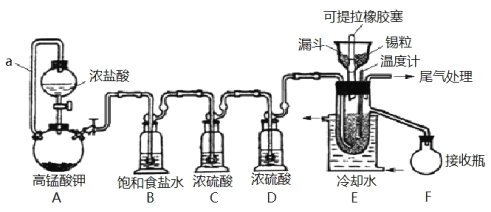
【题目】实验室可用溢流法连续制备无水四氯化锡(SnCl4)。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置图如图:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH=–511kJmol-1
可能用到的有关数据如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
制备过程中,锡粒逐渐被消耗,需提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。回答下列问题:
(1)a的作用是___。
(2)A中反应的化学方程式是___。
(3)B的作用是___。
(4)E中冷却水的作用是___。
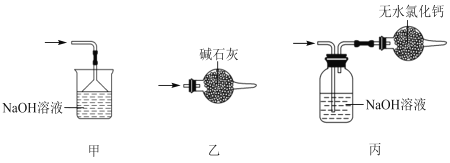
(5)尾气处理时,可选用的装置是___(填序号)。
(6)锡粒中含铜杂质致 E 中产生 CuCl2,但不影响 F 中产品的纯度,原因是___。
(7)SnCl4粗品中含有Cl2,精制时加入少许锡屑后蒸馏可得纯净的SnCl4。蒸馏过程中不需要用到的仪器有___(填序号)
A.分液漏斗 B.温度计 C.吸滤瓶 D.冷凝管 E.蒸馏烧瓶