题目内容
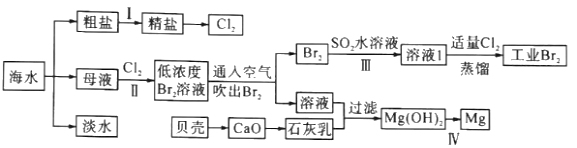
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式:__。
(2)海水提溴,制得1molBr2需要消耗__molCl2。步骤Ⅱ中需要向母液中加入稀硫酸酸化,其作用是___。步骤Ⅱ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为___。
(3)判断Mg(OH)2是否洗涤干净的操作是___。
【答案】Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓ 2 抑制氯气和水反应 Br2+SO32-+H2O=SO42-2H++2Br- 取最后的洗涤液少量于试管中,向其中加入HNO3酸化的AgNO3溶液,如果没有沉淀产生,证明沉淀已经洗涤干净
【解析】
海水晒盐后得到粗盐,淡水,粗盐提纯除去所含杂质Ca2+、Mg2+、SO42-及泥沙,得到精盐,电解制备氯气;母液中主要是溴离子和镁离子,通入氯气把溴离子氧化为溴单质,吹出后和二氧化硫气体通入水中得到卤水溶液和溴化氢溶液,富集溴,适量氯气氧化溴化氢为溴单质;含氯化镁的溶液中加入贝壳高温分解生成的氧化钙溶于水生成的氢氧化钙石灰乳,沉淀镁离子,过滤后在沉淀中加入盐酸溶解,通过浓缩蒸发,冷却结晶过滤洗涤得到氯化镁晶体,失水得到氯化镁固体,电解得到镁。
(1)SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸,溶液中含有钡离子、钙离子,加入Na2CO3溶液后,反应的离子方程式为Ca2++CO32-═CaCO3↓、Ba2++CO32-═BaCO3↓,故答案为:Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓;
(2)提取溴的原理是利用氯气的氧化性氧化溴离子生成的溴单质,Cl2+2Br-=Br2+2Cl-,海水提溴,涉及溴的富集,先后需要两步氧化溴,则制得1mol Br2需要消耗氯气2mol,步骤Ⅱ中需要向母液中加入稀硫酸酸化是抑制氯气和水的反应,步骤Ⅲ若用Na2SO3水溶液吸收Br2 反应生成硫酸钠、溴化钠,反应的离子方程式为 Br2+SO32-+H2O=SO42-+2H++2Br-,故答案为:2; 抑制氯气和水反应; Br2+SO32-+H2O=SO42-+2H++2Br-;
(3)判断Mg(OH)2是否洗涤干净的操作是:取最后的洗涤液少量于试管中,向其中加入HNO3酸化的AgNO3溶液,如果没有沉淀产生,证明沉淀已经洗涤干净,故答案为:取最后的洗涤液少量于试管中,向其中加入HNO3酸化的AgNO3溶液,如果没有沉淀产生,证明沉淀已经洗涤干净。