题目内容
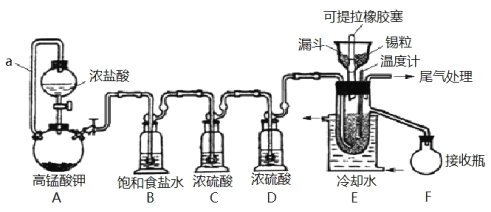
【题目】实验室可用溢流法连续制备无水四氯化锡(SnCl4)。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置图如图:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH=–511kJmol-1
可能用到的有关数据如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
制备过程中,锡粒逐渐被消耗,需提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。回答下列问题:
(1)a的作用是___。
(2)A中反应的化学方程式是___。
(3)B的作用是___。
(4)E中冷却水的作用是___。
(5)尾气处理时,可选用的装置是___(填序号)。
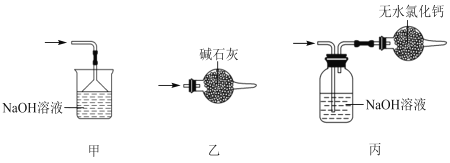
(6)锡粒中含铜杂质致 E 中产生 CuCl2,但不影响 F 中产品的纯度,原因是___。
(7)SnCl4粗品中含有Cl2,精制时加入少许锡屑后蒸馏可得纯净的SnCl4。蒸馏过程中不需要用到的仪器有___(填序号)
A.分液漏斗 B.温度计 C.吸滤瓶 D.冷凝管 E.蒸馏烧瓶
【答案】平衡压强,使浓盐酸顺利流下 2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O 除去氯气中混有的氯化氢气体 避免四氯化锡气化而损失,导致产率下降 乙 CuCl2熔点较高,不会随四氯化锡液体溢出 A、C
【解析】
SnCl4极易水解,反应应在无水环境下进行进行,装置A:采用KMnO4和浓盐酸反应的方法制取Cl2,反应还生成MnCl2,发生2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O,制取的氯气中含有氯化氢,通过饱和的氯化钠溶液洗去氯气中的氯化氢,SnCl4在空气中极易水解,利用浓硫酸的吸水性干燥氯气,防止产生SnCl4水解;然后Cl2和锡的反应,制备SnCl4,冷水冷却,可将气态的SnCl4冷凝回流收集产物;反应时应先生成氯气,将氧气排出。
(1)导管a的作用是平衡压强,可使分液漏斗内的液体顺利流下,故答案为:平衡压强,使浓盐酸顺利流下;
(2)实验采用KMnO4和浓盐酸反应的方法制取Cl2,反应还生成MnCl2,化学方程式为2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O,故答案为:2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O;
(3)B的作用是除去氯气中混有的氯化氢气体,故答案为:除去氯气中混有的氯化氢气体;
(4)SnCl4易挥发,冷水可降低温度,避免四氯化锡气化而损失,导致产率下降,故答案为:避免四氯化锡气化而损失,导致产率下降;
(5)尾气含有氯气,为避免四氯化锡水解,应用碱石灰,故答案为:乙;
(6)锡粒中含铜杂质致E中产生CuCl2,但不影响F中产品的纯度,原因是CuCl2熔点较高,不会随四氯化锡液体溢出,故答案为:CuCl2熔点较高,不会随四氯化锡液体溢出;
(7)蒸馏用到蒸馏烧瓶、温度计、接收器、冷凝管、锥形瓶,无需吸滤瓶和分液漏斗,故答案为:A、C。

 备战中考寒假系列答案
备战中考寒假系列答案