题目内容
【题目】三草酸合铁(Ⅲ)酸钾K3[Fe(C2O4)3]3H2O为绿色晶体,易溶于水,难溶于乙醇、丙酮等有机溶剂。
I.三草酸合铁(Ⅲ)酸钾晶体的制备
①将5g(NH4)2Fe(SO4)2·6H2O晶体溶于20mL水中,加入5滴6 mol·L-1H2SO4酸化,加热溶解,搅拌下加入25mL饱和H2C2O4溶液,加热,静置,待黄色的FeC2O4沉淀完全以后,倾去上层清液,倾析法洗涤沉淀2-3次。
②向沉淀中加入10mL饱和草酸钾溶液,水浴加热至40℃,用滴管缓慢滴加12mL5%H2O2,边加边搅拌并维持在40℃左右,溶液成绿色并有棕色的沉淀生成。
③加热煮沸一段时间后,再分两批共加入8mL饱和H2C2O4溶液(先加5mL,后慢慢滴加3mL)此时棕色沉淀溶解,变为绿色透明溶液。
④向滤液中缓慢加入10mL95%的乙醇,这时如果滤液浑浊可微热使其变清,放置暗处冷却,结晶完全后,抽滤,用少量洗涤剂洗涤晶体两次,抽干,干燥,称量,计算产率。
已知制备过程中涉及的主要反应方程式如下:步骤②6FeC2O4+3H2O2+6K2C2O4=4K3[Fe(C2O4)3]+2Fe(OH)3,步骤③2Fe(OH)3+3H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O,请回答下列各题:
(1)简述倾析法的适用范围______________,步骤③加热煮沸的目的是_______________。
(2)下列物质中最适合作为晶体洗涤剂的是____________________(填编号)。
A.冷水 B.丙酮 C.95%的乙醇 D.无水乙醇
(3)有关抽滤如图,下列说法正确的是_____________。

A.选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀
B.右图所示的抽滤装置中,只有一处错误,即漏斗颈口斜面没有对着吸滤瓶的支管口
C.抽滤得到的滤液应从吸滤瓶的支管口倒出
D.抽滤完毕后,应先拆下连接抽气泵和吸滤瓶的橡皮管,再关水龙头,以防倒吸
Ⅱ.纯度的测定
称取1.000g产品,配制成250mL溶液,移取25.00mL溶液,酸化后用标定浓度为0.01000 mol·L-1的高锰酸钾溶液滴定至终点,三次平行实验平均消耗高锰酸钾溶液24.00mL。
(4)滴定涉及反应的离子方程式:___________________________________。
(5)计算产品的纯度_____________________(用质量百分数表示)。(K3[Fe(C2O4)3]·3H2O的相对分子质量为491)
【答案】晶体颗粒较大,易沉降 除去多余的双氧水,提高草酸的利用率 C A、D ![]() 98.20%
98.20%
【解析】
(1)倾析法的适用范围适用分离晶体颗粒较大、易沉降到容器底部的沉淀,这样减少过滤的时间和操作,比较简单;对步骤②中的溶液经过加热煮沸再进行下一步操作,是由于步骤②溶液中存在过量的过氧化氢,过氧化氢具有一定的氧化性,会和③中加入的草酸发生反应,所以加热煮沸的目的是除去过量的双氧水,提高饱和H2C2O4溶液的利用率;
(2)因为产品不溶于乙醇,而选择95%的乙醇经济成本最低,故选C。
(3)该抽滤装置的操作原理为:打开最右侧水龙头,流体流速增大,压强减小,会导致整个装置中压强减小,使布氏漏斗内外存在压强差,加快过滤时水流下的速度,
A.选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀,A正确;
B.图示的抽滤装置中,除漏斗颈口斜面没有对着吸滤瓶的支管口外,中间瓶中的导管也没有“短进短出”,B错误;
C.抽滤得到的滤液应从瓶口倒出,不能从支管口倒出,C错误;
D.抽滤完毕后,应先拆下连接抽气泵和吸滤瓶的橡皮管,再关水龙头,以防倒吸,D正确;
故答案选AD。
(4)滴定涉及到的原理为草酸根离子能被酸性高锰酸钾氧化生成二氧化碳,离子方程式为:16H++2MnO4-+5C2O42-=2Mn2++10CO2↑+8H2O;
(5) 5K3[Fe(C204)3]·3H2O ~ 6KMnO4
491*5 6
m0.01×0.024×![]()
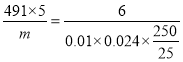
m=0.982g,则产品的纯度=0.982÷1.000=98.20%。

【题目】某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L.
阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
阴离子 | Cl﹣ CO32﹣ NO3﹣ SO42﹣ SiO32﹣ |
甲同学欲探究废水的组成,进行了如下实验:
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是_____________(写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是_______。
(3)将Ⅲ中红棕色气体(标况下)收集一试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为_________mol/L(精确到千分位)。
(4)甲同学最终确定原溶液中所含阳离子是___________,阴离子是_______。
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体为_________________,质量为_______________g。
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | 新制氯水滴入Na2S 溶液中 | 乙醇滴入K2Cr2O7酸性溶液中 | 饱和FeCl3溶液滴入沸水中 | 草酸滴入KMnO4 酸性溶液中 |
现象 | 产生黄色浑浊 | 溶液由橙色变为绿色 | 液体变为红褐色且澄清透明 | 产生无色气体,溶液紫红色褪去 |
A. AB. BC. CD. D
【题目】为确定某NH4NO3和(NH4)2SO4混合物的组成,称取4份样品分别加入50.0mL相同浓度的NaOH溶液中,加热充分反应(加热后氨气全部逸出)。加入的混合物的质量和产生的气体体积(标准状况)的关系如下表:
实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
NaOH溶液体积(mL) | 50.0 | 50.0 | 50.0 | 50.0 |
样品质量(g) | 3.44 | m | 17.2 | 21.5 |
NH3体积(L) | 1.12 | 2.24 | 5.60 | 5.60 |
试计算:
(1)m=________g;c(NaOH)=___________ mol·L-1
(2)样品中NH4NO3和(NH4)2SO4物质的量之比为______________。
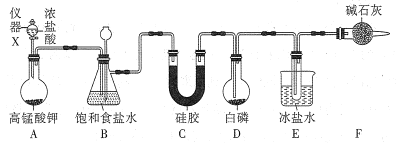
【题目】三氯化磷(PCl3)是一种基础化工原料使用广泛需求量大。实验室可用白磷与氯气反应制备三氯化磷,实验装置如图所示(夹持装置未画出)。
已知:①氯气与白磷反应放出热量(温度高于75℃)。
②PCl3和PCl5遇水强烈反应并产生大量的白雾。
③PCl3和PCl5的物理常数如下:
熔点 | 沸点 | |
PCl3 | -112℃ | 76℃ |
PCl5 | 146℃ | 200℃分解 |
回答下列问题:
(1)仪器X的名称是___;装置A中发生反应的离子方程式为___。
(2)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C或D中是否发生堵塞,若装置C或D中发生堵塞时B中的现象是__。
(3)为防止装置D因局部过热而炸裂,实验开始前应在圆底烧瓶的底部放少量__(填“干沙”或“水”)。
(4)装置E的烧杯中冰盐水的作用是___。
(5)装置F的作用:一是防止空气中水蒸气的进入;二是___。
(6)前期白磷过量生成PCl3,后期氯气过量生成PCl5,从PC13和PCl5的混合物中分离出PCl3的最佳方法是___。


