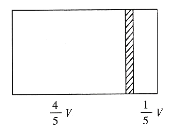
��Ŀ����
����Ŀ����.KClO3��Ũ������һ���¶��·�Ӧ�������ɳȻ�ɫ���ױ����������(ClO2)���壬�÷�Ӧ�Ļ�ѧ����ʽΪ2KClO3+4HCl(Ũ)=2KCl+2ClO2��+Cl2��+2H2O��
��1���÷�Ӧ�Ļ�ԭ������_____________ (�ѧʽ)��
��2���ڷ�Ӧ��Ũ������ֳ�����������________(����ĸ)��
A ֻ�л�ԭ�� B ֻ�������� C ��ԭ�Ժ����� D �����Ժ�����
��3�����÷�Ӧ����2.24L(��״��)ClO2����ת�Ƶ��ӵ����ʵ���Ϊ_____________��
��4��ij�������������ƾ����к��������ľ綾�����軯��(NaCN)����ClO2�ɳ�ȥ���е��軯�ƣ��Ӷ��õ�������ʳ�Σ�ͬʱ�������������塣д���÷�Ӧ�Ļ�ѧ����ʽ: __________��
��.��5��һ�������£�PbO2��Cr3+��Ӧ��������Cr2O72-��Pb2+������1molCr3+��Ӧ����PbO2�����ʵ���Ϊ_______mol��
��6����һ�������£�ʵ���ҷֱ��Թ������⡢������ء������Ϊԭ����ȡ���������Ƶ�ͬ��ͬѹ����ͬ���������ʱ��������Ӧ��ת�Ƶĵ�����֮��Ϊ_____________��
���𰸡�ClO2 C 0.1 mol 2ClO2+2NaCN=2CO2+N2+2NaCl 1.5 mol 1:2:2
��������
��. �ڷ�Ӧ2KClO3+4HCl(Ũ)=2KCl+2ClO2��+Cl2��+2H2O�У�KClO3Ϊ��������HCl(Ϊ��ԭ����ClO2����������Ӧ�Ļ�ԭ���Cl2�ǻ�ԭ����Ӧ���������
��1���ɴ˿�֪�÷�Ӧ�Ļ�ԭ���
��2���ڷ�Ӧ�У�Ũ��������KCl�����ֳ����ԣ�Ũ��������Cl2�����ֳ���ԭ�ԡ�
��3������2.24L(��״��)ClO2����0.1mol ClO2����ʱCl��+5�۽���Ϊ+4�ۣ��ɴ˿����ת�Ƶ��ӵ����ʵ�����
��4��ij�������������ƾ����к��������ľ綾�����軯��(NaCN)����ClO2�ɳ�ȥ���е��軯�ƣ��Ӷ��õ�������ʳ�Σ�ͬʱ�������������壬������ΪN2��CO2��ClO2����ԭΪCl-��
��.��5��һ�������£�PbO2��Cr3+��Ӧ��������Cr2O72-��Pb2+������1molCr3+��Ӧʧ����3mol��PbO2�õ���ҲӦΪ3mol��PbO2�е�Pb��+4�۽���Ϊ+2�ۣ�����ʧ����������ȣ����������PbO2�����ʵ�����
��6����һ�������£�ʵ���ҷֱ��Թ������⡢������ء������Ϊԭ����ȡ���������Ƶ�ͬ��ͬѹ����ͬ���������ʱ�����������е�O��-1������Ϊ0�ۣ�������ء�������е�O��-2������Ϊ0�ۣ��ɴ˿����������Ӧ��ת�Ƶĵ�����֮�ȡ�
��. �ڷ�Ӧ2KClO3+4HCl(Ũ)=2KCl+2ClO2��+Cl2��+2H2O�У�KClO3Ϊ��������HCl(Ϊ��ԭ����ClO2����������Ӧ�Ļ�ԭ���Cl2�ǻ�ԭ����Ӧ���������
��1���ɴ˿�֪�÷�Ӧ�Ļ�ԭ����ΪClO2����Ϊ��ClO2��
��2���ڷ�Ӧ�У�Ũ��������KCl�����ֳ����ԣ�Ũ��������Cl2�����ֳ���ԭ�ԡ���Ϊ��C��
��3������2.24L(��״��)ClO2����0.1mol ClO2����ʱCl��+5�۽���Ϊ+4�ۣ��ɴ˿����ת�Ƶ��ӵ����ʵ���Ϊ0.1 mol����Ϊ��0.1 mol��
��4��ij�������������ƾ����к��������ľ綾�����軯��(NaCN)����ClO2�ɳ�ȥ���е��軯�ƣ��Ӷ��õ�������ʳ�Σ�ͬʱ�������������壬������ΪN2��CO2��ClO2����ԭΪCl-����Ӧ�����ӷ���ʽΪ2ClO2+2NaCN=2CO2+N2+2NaCl����Ϊ��2ClO2+2NaCN=2CO2+N2+2NaCl��
��.��5��һ�������£�PbO2��Cr3+��Ӧ��������Cr2O72-��Pb2+������1molCr3+��Ӧʧ����3mol��PbO2�õ���ҲӦΪ3mol��PbO2�е�Pb��+4�۽���Ϊ+2�ۣ�����ʧ����������ȣ����������PbO2�����ʵ���![]() =1.5mol����Ϊ��1.5mol��
=1.5mol������1.5mol��
��6����һ�������£�ʵ���ҷֱ��Թ������⡢������ء������Ϊԭ����ȡ���������Ƶ�ͬ��ͬѹ����ͬ���������(����Ϊ1mol)ʱ�����������е�O��-1������Ϊ0�ۣ�������ء�������е�O��-2������Ϊ0�ۣ��ɴ˿����������Ӧ��ת�Ƶĵ�����֮��2��4��4=1:2:2����Ϊ��1:2:2��