题目内容
5.由H2与CO组成的混合气体1.5g,在标准状况下其体积为2.24L,则混合气体中H2的物质的量为( )| A. | 0.01mol | B. | 0.03mol | C. | 0.05mol | D. | 0.07mol |
分析 根据公式m=nM,V=nVm进行计算即可.
解答 解:混合气体在标准状况下其体积为2.24L即0.1mol,设混合气体中H2的物质的量为x,则CO的物质的量是(0.1-x)mol,由H2与CO组成的混合气体1.5g,得到:2x+28(0.1-x)=1.5,解得x=0.05mol,则混合气体中H2的物质的量为0.05mol,
故选C.
点评 本题考查混合物的计算,题目难度不大,注意有关计算公式的运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列实验操作能达到实验目的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 向盛有1mL2%的硝酸银溶液中逐滴加入2%稀氨水,边滴边振荡至最初产生的沉淀恰好消失为止 | 配制少量银氨溶液 |
| B | 向盛有2mL10%的硫酸铜溶液的试管中滴加0.5mL10%氢氧化钠溶液,混合均匀,滴入待检液,加热 | 检验某溶液中是否含有醛基 |
| C | 向淀粉溶液中加入稀硫酸,加热一段时间后,再加入银氨溶液 | 检验淀粉是否水解完全 |
| D | 将氯乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合溶液中滴加硝酸银溶液 | 检验水解产物中的氯离子 |
| A. | A | B. | B | C. | C | D. | D |
13.除去蛋清中混有的少量Cl-的方法是( )
| A. | 加入少量硝酸银溶液 | B. | 过滤 | ||
| C. | 电泳 | D. | 渗析 |
20.下列电解质在水溶液中和熔化状态下均能导电的是( )
| A. | 硫酸 | B. | 碳酸钙 | C. | 氢氧化钠 | D. | 氧化镁 |
17.若NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 在密闭容器中加入3mol H2和1molN2,充分反应后可得到NH3分子数为2NA | |
| B. | 0.1mol/L Na2SO4溶液中含有Na+为0.2NA | |
| C. | 一定条件下,23 g Na与O2反应生成Na2O2时失去的电子数为NA | |
| D. | 标准状况下,22.4L SO3中含有的氯原子数为3NA |
14.将一定量的氯气通入60mL浓度为10.00mol/L的热的氢氧化钠浓溶液中,溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断不正确的是( )
| A. | 与NaOH反应的氯气一定为0.3 mol | |
| B. | n(Na+):n(Cl-) 可能为7:3 | |
| C. | 若反应中转移的电子为n mol,则0.3<n<0.5 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11:1:2 |

 .
.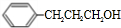
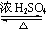
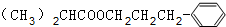 +H2O.
+H2O. .
.