题目内容
14.将一定量的氯气通入60mL浓度为10.00mol/L的热的氢氧化钠浓溶液中,溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断不正确的是( )| A. | 与NaOH反应的氯气一定为0.3 mol | |
| B. | n(Na+):n(Cl-) 可能为7:3 | |
| C. | 若反应中转移的电子为n mol,则0.3<n<0.5 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11:1:2 |
分析 A、由于反应后体系中没有NaOH,故氢氧化钠反应完,根据钠元素守恒n(NaOH)=n(NaCl)+n(NaClO)+n(NaClO3),再根据氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3),据此计算;
B、根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,n(Na+):n(Cl-)最大为2:1,当氧化产物为NaClO3,n(Na+):n(Cl-)最小为6:5,据此判断;
C、利用极限法解答,根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,转移电子数最少,氧化产物只有NaClO3,转移电子数最多;
D、令n(NaCl)=11mol,n(NaClO)=1mol,n(NaClO3)=2mol,根据电子转移守恒验证判断.
解答 解:A、由于反应后体系中没有NaOH,故氢氧化钠反应完,根据钠元素守恒n(NaOH)=n(NaCl)+n(NaClO)+n(NaClO3)=0.06L×10mol/L=0.6mol,根据氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3)=0.6mol,故参加反应的氯气n(Cl2)=0.3mol,故A正确;
B、根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,n(Na+):n(Cl-)最大为2:1,当氧化产物为NaClO3,n(Na+):n(Cl-)最小为6:5,故6:5<n(Na+):n(Cl-)<2:1,7:3>2:1,故B错误;
C、根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,转移电子数最少,为0.6mol×$\frac{1}{2}$×1=0.3mol,氧化产物只有NaClO3,转移电子数最多,为0.6mol×$\frac{5}{6}$×1=0.5mol,所以若反应中转移的电子为n mol,则0.3<n<0.5,故C正确;
D、令n(NaCl)=11mol,n(NaClO)=1mol,n(NaClO3)=2mol,生成NaCl获得的电子为11mol×1=11mol,生成NaClO、NaClO3失去的电子为1mol×1+2mol×5=11mol,得失电子相等,故D正确;
故选B.
点评 本题考查氧化还原反应计算、根据方程式的计算等,难度较大,注意极限法与守恒法的利用.

 名校课堂系列答案
名校课堂系列答案 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
(2)A、C、D 三种元素的最高价氧化物对应的水化物中碱性最强的是NaOH(填化学式).
(3)A、B、C 三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+.(用元素的离子符号表示).
(4)X 元素是 A~R 十种元素中的一种,X 的氢氧化物既能与氢氧化钠溶液反应,又能与盐酸反应.则 X 的最高价氧化物对应水化物与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
| A. | 0.01mol | B. | 0.03mol | C. | 0.05mol | D. | 0.07mol |
| A. | 现有CO CO2 O3三种气体,它们分别都含有1摩尔O,则三种气体的物质的量之比3:2:1 | |
| B. | 5.6gCO和22.4L CO2中含有碳原子数一定相等 | |
| C. | 标况下,11.2升X气体分子质量为16g,则X气体的摩尔质量为32 | |
| D. | ngCl2中有m个Cl原子,则阿伏伽德罗常数NA的数值可以表示为 35.5m/n |
| A. |  长颈漏斗 | B. |  表面皿 | C. |  三脚架 | D. |  瓷钳锅 |
| A. | KClO3是氧化剂 | |
| B. | H2O既不是氧化产物也不是还原产物 | |
| C. | HCl是还原剂 | |
| D. | KCl既是还原产物也是氧化产物 |
| A. | 广泛PH试纸可测定某溶液的PH值为13 | |
| B. | 将PH试纸湿润后,测得的PH值一定有误差 | |
| C. | 用PH试纸蘸取溶液,过半分钟与标准比色卡对比 | |
| D. | 精密pH试纸,测得的PH值一定不能为7.0 |
| A. | H2SO4═2H++4SO2- | B. | CuSO4═Cu++SO4- | C. | Ba(OH)2═Ba2++2OH- | D. | FeCl3═Fe2++3Cl- |
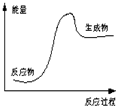
| A. | 该反应为吸热反应 | |
| B. | 该图可以表示石灰石高温分解 | |
| C. | 反应物比生成物稳定 | |
| D. | 因为生成物的总能量高于反应物的总能量,所以该反应一定需要加热 |