题目内容
5.A、B、C、D为原子序数依次增大的短周期主族元素,B2-和D3+的电子层结构相同,A-的电子层结构与氦相同,C是同周期原子半径最大的元素,下列说法错误的是( )| A. | 离子半径:B2->D3+ | |
| B. | 最高价氧化物对应的水化物碱性:C>D | |
| C. | 失电子能力:A>C | |
| D. | A与B可形成共价化合物:A2B、A2B2 |
分析 A、B、C、D为原子序数依次增大的短周期主族元素,A-的电子层结构与氦相同,则A为H元素,B2-和D3+的电子层结构相同,B处于第二周期、D处于第三周期,由离子电荷可知,B为O元素、D为Al,C是同周期原子半径最大的元素,原子序数大于氧、小于Al,只能处于第三周期,故C为Na,据此解答.
解答 解:A、B、C、D为原子序数依次增大的短周期主族元素,A-的电子层结构与氦相同,则A为H元素,B2-和D3+的电子层结构相同,B处于第二周期、D处于第三周期,由离子电荷可知,B为O元素、D为Al,C是同周期原子半径最大的元素,原子序数大于氧、小于Al,只能处于第三周期,故C为Na.
A.O2-和Al3+的电子层结构相同,核电荷数越大离子半径越小,故离子半径O2->Al3+,故A正确;
B.非金属性C(Na)>D(Al),故碱性:氢氧化钠>氢氧化铝,故B正确;
C.A为H,属于非金属元素,C为Na,属于金属元素,C元素失去电子能力更强,故C错误;
D.H元素与O元素可形成共价化合物:H2O、H2O2,故D正确.
故选:C.
点评 本题考查原子结构与元素周期律,推断元素是解题关键,熟练掌握短周期元素,理解元素周期律的应用.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
13.下列说法错误的是( )
| A. | 氢氧化钠溶液应保存在带磨砂玻璃塞的无色细口瓶中 | |
| B. | 二氧化硅是制造光导纤维的材料 | |
| C. | 水玻璃可用作木材防火剂 | |
| D. | 氢氟酸能与二氧化硅反应,因此可用于刻蚀玻璃 |
20.下列各化合物中能发生酯化反应,且显酸性的是( )
| A. | CH2=CH-CH2OH | B. | HO-CH2-CH2-CH2-COOH | ||
| C. | HNO3 | D. | 乙醇 |
10.中国女药学家屠呦呦因研制新型抗疟药青蒿素和双氢青蒿素成果而获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素结构如图所示:下列关于青蒿素和双氢青蒿素的说法不正确的( )
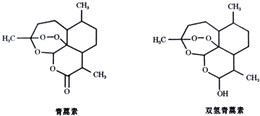

| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素和双氢青蒿素不是同分异构体 | |
| C. | 青蒿素和双氢青蒿素都能发生酯化反应 | |
| D. | 青蒿素在稀硫酸催化条件下能发生水解反应 |
14.下表中实验操作、现象和所得出的结论均正确的是
( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将KI和FeCl3溶液在试管中混合后,滴加KSCN溶液 | 溶液变红色 | 氧化性:Fe2+>I2 |
| B | 少量的乙烯通入pH=3的溴水中 | 溴水褪色,pH基本不变 | 两者发生的加成反应 |
| C | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 溶液中一定无NH4+ |
| D | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HA酸性比HB强 |
| A. | A | B. | B | C. | C | D. | D |
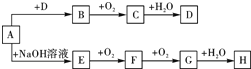 A~H等8种物质存在如下转化关系(反应条件,部分产物未标出).已知:A是正盐,B是能使品红溶液褪色的气体,G是红棕色气体.按要求回答问题:
A~H等8种物质存在如下转化关系(反应条件,部分产物未标出).已知:A是正盐,B是能使品红溶液褪色的气体,G是红棕色气体.按要求回答问题: E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2-具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2-具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性