题目内容
7.N2O5(g)?N2O3(g)+O2(g); N2O3(g)?N2O(g)+O2(g)在0.5L的密闭容器中,将2.5mol N2O5加热气化,并按上式分解,当在某温度下达到化学平衡时,O2的平衡浓度为4.4mol•L-1,N2O3的平衡浓度为1.6mol•L-1,计算:
(1)N2O5的分解率是多少?
(2)N2O的平衡浓度是多少?
分析 根据N原子守恒:c平衡(N2O5)+c平衡(N2O3)+c平衡(N2O)=c起始(N2O5),根据O原子守恒:5c平衡(N2O5)+3c平衡(N2O3)+c平衡(N2O)+2c平衡(O2)=5c起始(N2O5),联立方程计算平衡时N2O5、N2O的平衡浓度,N2O5的转化率=$\frac{{N}_{2}{O}_{5}浓度变化量}{{N}_{2}{O}_{5}起始浓度}$×100%.
解答 解:N2O5的起始浓度为:$\frac{2.5mol}{0.5L}$=5mol/L,
根据N原子守恒:c平衡(N2O5)+c平衡(N2O3)+c平衡(N2O)=c起始(N2O5),即:
c平衡(N2O5)+1.6mol/L+c平衡(N2O)=5mol/L,
根据O原子守恒:5c平衡(N2O5)+3c平衡(N2O3)+c平衡(N2O)+2c平衡(O2)=5c起始(N2O5),即:
5c平衡(N2O5)+3×1.6mol/L+c平衡(N2O)+2×4.4mol/L=5×5mol/L,
联立方程解得:c平衡(N2O5)=2mol/L、c平衡(N2O)=1.4mol/L,
(1)N2O5的转化率为:$\frac{5mol/L-2mol/L}{5mol/L}$×100%=60%,
答:N2O5的分解率是60%;
(2)根据分析可知,N2O的平衡浓度是1.4mol/L,
答:N2O的平衡浓度是1.4mol/L.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响因素为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学实验能力.

下列关于金属钠的叙述错误的是( )
A.钠的还原性很强,只能以化合态存在于自然界
B.钠质地柔软,可用小刀切割,保存在煤油中
C.钠失火后可用大量水或泡沫灭火器扑灭
D.钠的焰色反应为黄色,可用在雾天做指示灯
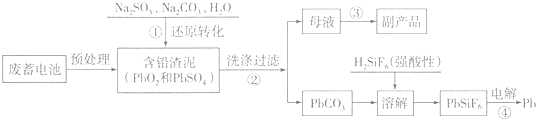
已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.
回答下列问题:
(1)写出步骤①中PbSO4转化为PbCO3过程的平衡常数表达式K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$,为提高步骤①的反应速率和铅浸出率,你认为可采取的两条措施是充分搅拌、适当升高温度.
(2)步骤①中发生的氧化还原反应的离子方程式为PbO2+SO32-+H2O=PbSO4+2OH-.
(3)写出步骤④用惰性电极电解的阴极反应式Pb2++2e-=Pb.
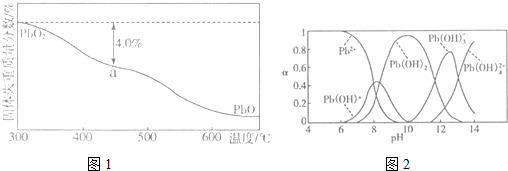
(4)PbO2在加热过程发生分解的失重曲线如图1所示,已知失重曲线上的a点为样品失重4.0%(即$\frac{样品起始质量-a点固体质量}{样品起始质量}$×100%)的残留固体,若a点固体组成表示为PbOx,计算x=1.4.
(5)铅的加工同样会使水体中重金属铅的含量增大造成严重污染.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-.各形态的浓度分数α随溶液pH变化的关系如图2所示,某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如表
| 离子/(mol.L-1) | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度 | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度 | 0.004 | 22.6 | 0.040 | 0.053 | 49.9 |
A.4~5 B.6~7 C.9~10 D.11~12.
| 选项 | 溶液 | 粒子浓度关系 |
| A | CH3COOK溶液中加入少量NaNO3固体后 | c(K+)+c(H+)=c(CH3COO-)+c(OH-) |
| B | 新制氯水 | c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| C | NH4HSO4溶液 | c(H+)=c(NH4+)+c(NH3•H2O)+c(OH-) |
| D | 0.1mol•L-1,pH为4的NaHB溶液 | c(HB-)>c(H2B)>c(B2-) |
| A. | A | B. | B | C. | C | D. | D |
 ,Z元素在周期表中的位置为第三周期第ⅥⅠA族族,能否用下面的反应证明Z的非金属性比碳强:2HCl+Na2CO3=NaCl+H2O+CO2↑否(填“能”或“否”)
,Z元素在周期表中的位置为第三周期第ⅥⅠA族族,能否用下面的反应证明Z的非金属性比碳强:2HCl+Na2CO3=NaCl+H2O+CO2↑否(填“能”或“否”)

