题目内容
10.乙醛酸(OHC-COOH)是合成名贵香料的原料之一.I.由乙二醛催化氧化制乙醛酸的反应如下:
2OHC-CHO(g)+O2(g)?2OHC-COOH(g)△H
(1)已知反应中相关的化学键键能数据如表:
| 化学键 | O=O | C-O | O-H | C-H |
| 键能(kJ•mol-1) | 498 | 351 | 465 | 413 |
(2)一定条件下,按照$\frac{n({O}_{2})}{n(OHC-CHO)}$=$\frac{1}{2}$投料比进行上述反应,乙二醛的平衡转化率(a)和催化剂催化效率随温度变化如图1所示.
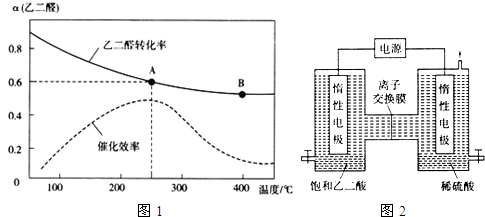
①该反应在A点放出的热量>(填“>”、“=”或“<”)B点放出的热量.
②某同学据图推知,生成乙醛酸的速率:v(A)>v(B),你认为此结论是否正确,简述理由.不正确,温度越高,催化效率越高,化学反应速率越快,而A点的温度低、催化效率高,B点的温度高、催化效率低,所以无法比较速率大小
③图中A点时,乙醛酸的体积分数为50%.
④为提高乙二醛的平衡转化率,除改变投料比、温度外,还可以采取的措施有增大压强或及时分离出乙醛酸(列举一条).
Ⅱ.利用惰性电极电解饱和乙二酸和稀硫酸溶液也可以制备乙醛酸,原理如图2所示.
(1)图中的离子交换膜为阳(填“阳”或“阴”)膜.
(2)稀硫酸的作用为提供氢离子,作电解质溶液.
(3)生成乙醛酸的电极反应式为HOOC-COOH+2H++2e-→OHC-COOH+H2O.
分析 Ⅰ(1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,该反应的反应热为:2molC-H、1molO=0总键能与2molC-O、2molO-H总键能之差;
(2)①曲线上的点代表一定温度下平衡时乙二醛的转化率,A点转化率高于B点,A点乙二醛转化得更多,由于此反应是一个放热反应,说明乙二醛转化得越多,放的热就越多;
②由图象据温度、催化剂对反应速率的影响分析;
③若投料比按照$\frac{n({O}_{2})}{n(OHC-CHO)}$=$\frac{1}{2}$,设O2为1mol、OHC-CHO为2mol,A点时乙二醛的转化率为60%,则转化的乙二醛为1.2mol,计算出平衡时各组分的物质的量,乙醛酸的体积分数为=$\frac{乙醛酸的物质的量}{气体总物质的量}$×100%;
④为提高乙二醛的平衡转化率,应改变条件使平衡正向移动,除改变温度外,还可采取的措施是增大压强,或将产物分离出来;
Ⅱ由图可知,左边电极通入饱和乙二酸,生成乙醛酸,发生还原反应,则左边为阴极,乙二酸获得电子,与通过质子交换膜的氢离子反应生成乙醛酸和水,据此解答.
解答 解:(1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,该反应的反应热为:2molC-H、1molO=0总键能与2molC-O、2molO-H总键能之差,
△H=2mol×413kJ•mol-1+1mol×498kJ•mol-1-2mol×(351kJ•mol-1+465kJ•mol-1)=-308kJ•mol-1,
故答案为:-308;
(2)①曲线上的点代表一定温度下平衡时乙二醛的转化率,A点转化率高于B点,A点乙二醛转化得更多,由于此反应是一个放热反应,说明乙二醛转化得越多,放的热量就越多,则A点放出的热量多于B点放出的热量,
故答案为:>;
②温度越高,催化效率越高,化学反应速率越快,而A点的温度低、催化效率高,B点的温度高、催化效率低,所以无法比较速率大小,
故答案为:不正确,温度越高,催化效率越高,化学反应速率越快,而A点的温度低、催化效率高,B点的温度高、催化效率低,所以无法比较速率大小;
③若投料比按照$\frac{n({O}_{2})}{n(OHC-CHO)}$=$\frac{1}{2}$,设O2为1mol、OHC-CHO为2mol,A点时乙二醛的转化率为60%,则转化的乙二醛为1.2mol,根据三行式:
2OHC-CHO(g)+O2(g)?2OHC-COOH(g)
△起始(mol):2 1 0
变化(mol):1.2 0.6 1.2
平衡(mol):0.8 0.4 1.2
所以乙醛酸的体积分数为=$\frac{乙醛酸的物质的量}{气体总物质的量}$×100%=$\frac{1.2mol}{0.8mol+0.4mol+1.2mol}$×100%=50%,
故答案为:50%;
④为提高乙二醛的平衡转化率,应改变条件使平衡正向移动,除改变温度外,还可采取的措施是增大压强,或将产物分离出来,
故答案为:增大压强或及时分离出乙醛酸;
Ⅱ(1)由图可知,左边电极通入饱和乙二酸,生成乙醛酸,说明乙二酸发生还原反应,则左边为阴极,乙二酸获得电子,与通过质子交换膜的氢离子反应生成乙醛酸和水,说明离子交换膜是阳离子交换膜,
故答案为:阳;
(2)乙二酸与通过质子交换膜的氢离子反应生成乙醛酸和水,说明稀硫酸的作用是提供氢离子,作电解质溶液,
故答案为:提供氢离子,作电解质溶液;
(3)乙二酸得到电子,与通过质子交换膜的氢离子反应生成乙醛酸和水,电极反应式为:HOOC-COOH+2H++2e-→OHC-COOH+H2O,
故答案为:HOOC-COOH+2H++2e-→OHC-COOH+H2O.
点评 本题考查反应热、化学平衡计算以及反应速率、化学平衡的影响因素,要求学生灵活运用知识,综合性较强,在第Ⅱ中以有机物为载体考查电化学知识,比较新颖,思维跨度大.

 阅读快车系列答案
阅读快车系列答案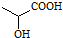 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A. | 葡萄糖和乳酸含有相同的官能团 | |
| B. | 向葡萄糖溶液加入氢氧化铜悬浊液,加热一定有砖红色沉淀生成 | |
| C. | 乳酸能发生催化氧化、加成和取代反应 | |
| D. | 分子式C3H6O3,且含有羟基、羧基的有机物共有2种 |
 ,Z元素在周期表中的位置为第三周期第ⅥⅠA族族,能否用下面的反应证明Z的非金属性比碳强:2HCl+Na2CO3=NaCl+H2O+CO2↑否(填“能”或“否”)
,Z元素在周期表中的位置为第三周期第ⅥⅠA族族,能否用下面的反应证明Z的非金属性比碳强:2HCl+Na2CO3=NaCl+H2O+CO2↑否(填“能”或“否”)



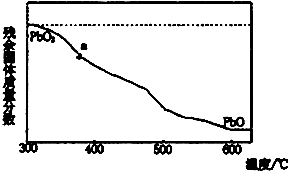 (1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3
(1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3