题目内容
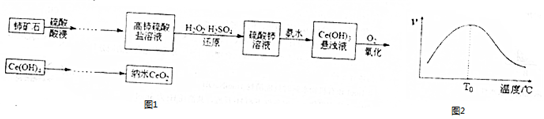
12.1,4-环已二醇可通过如图路线合成(某些反应的反应物和反应条件未列出):
(1)写出反应④、⑦的化学方程式:
④
 ;
;⑦
 .
.(2)②的反应类型是消去反应,上述七个反应中属于加成反应的有③⑤⑥.(填反应序号)
(3)反应⑤中可能产生一定量的副产物,写出它们的结构简式:
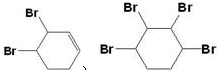 .
.
分析 由转化关系可知A为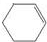 ,B为
,B为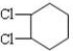 或溴代烃,C为
或溴代烃,C为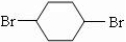 ,结合有机物的结构和性质以及题目要求解答该题.
,结合有机物的结构和性质以及题目要求解答该题.
解答 解:由转化关系可知A为 ,B为
,B为 或溴代烃,C为
或溴代烃,C为 ,
,
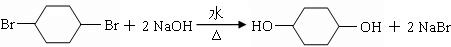
(1)B为 ,在NaOH醇溶液中加热发生消去反应,反应的方程式为
,在NaOH醇溶液中加热发生消去反应,反应的方程式为 ,C为
,C为 ,在NaOH溶液中发生取代反应,反应的方程式为
,在NaOH溶液中发生取代反应,反应的方程式为 ,
,
故答案为: ;
; ;
;
(2)由反应条件和物质的转化可知,反应①为取代反应,②为消去反应,③为加成反应,④为消去反应,⑤加成反应,⑥为加成反应,⑦为取代反应,
故答案为:消去反应;③⑤⑥;
(3)反应⑤可能与溴发生1,2加成或1,4加成,也可与2mol溴完全发生加成反应,除题中物质之外,还可能生成 ,
,
故答案为: .
.
点评 本题考查有机物的合成,为高频考点,把握有机物官能团的变化以及反应条件为解答的关键,侧重分析与推断能力的考查,注意该题可正推判断有机物,题目难度不大.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
2.假设SiO2原子晶体中Si原子被Al原子取代,不足的价数由K原子补充.当有25%的硅原子被铝原子取代时,可形成正长石,则正长石的化学组成为( )
| A. | KAlSiO4 | B. | KAlSi2O6 | C. | KAlSi3O8 | D. | KAlSi4O10 |
3.根据有机化合物的命名原则,下列命名正确的是( )
| A. | CH3CH=C(CH3) CH3 3-甲基-2-丁烯 | |
| B. | CH3CH(CH3)CH(Cl)CH3 3-甲基-2-氯丁烷 | |
| C. | CH3CH(OH)CH2CH3 3-羟基丁醇 | |
| D. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 |
20.已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构.下列关于X、Y、Z、W四种元素的描述,不正确的是( )
| A. | 原子半径:X>Y>W>Z | B. | 原子序数:Y>X>Z>W | ||
| C. | 原子最外层电子数:Y>X>Z>W | D. | 原子的电子层数:X=Y>W=Z |
7.下列叙述中,正确的是( )
| A. | C、N、O元素的单质与氢气化合越来越难 | |
| B. | Li、Na、K的氧化物的水化物的碱性依次减弱 | |
| C. | Na、Mg、Al的简单离子的氧化性以依次增强 | |
| D. | P、S、Cl元素的最高正价依次升高,其对应的气态氢化物的稳定性依次减弱 |
4.某一元弱酸溶液的c(H+)=0.1mol/L,该酸溶液的物质的量浓度为( )
| A. | 等于0.1mol/L | B. | 大于0.1mol/L | C. | 小于0.1mol/L | D. | 无法判断 |