题目内容
20.已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构.下列关于X、Y、Z、W四种元素的描述,不正确的是( )| A. | 原子半径:X>Y>W>Z | B. | 原子序数:Y>X>Z>W | ||
| C. | 原子最外层电子数:Y>X>Z>W | D. | 原子的电子层数:X=Y>W=Z |
分析 X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构,则X、Y在Z、W的下一周期,原子序数为Y>X>Z>W,金属性X>Y,非金属性Z>W,以此来解答.
解答 解:X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构,则X、Y在Z、W的下一周期,原子序数为Y>X>Z>W,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:X>Y>W>Z,故A正确;
B.由上述分析可知,原子序数为Y>X>Z>W,故B正确;
C.X、Y、Z、W的最外层电子数分别为1、2、7、6,则原子最外层电子数:Z>W>Y>X,故C错误;
D.X、Y在Z、W的下一周期,原子的电子层数:X=Y>W=Z,故D正确;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握电子层结构、电子排布规律来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
10.下列实验操作中正确的是( )
| A. | 实验桌上的酒精灯倾倒了燃烧起来,马上用湿布盖灭 | |
| B. | 在取用NaOH固体时,发现取量过多,为了不浪费,又把多余的药品放回试剂瓶 | |
| C. | 用氢气还原氧化铜时,应先通一会儿氢气,再加热氧化铜 | |
| D. | 制取并收集氧气结束后,应立即停止加热 |
8.放射性元素${\;}_{112}^{277}$Cn的一个原子经过6次衰变(每次衰变都放出一个相同的粒子)后,得到比较稳定的第100号元素镄(Fm)的含153个中子的原子.下列说法中正确的是( )
| A. | 每次衰变都放出24H | |
| B. | 每次衰变都放出T | |
| C. | ${\;}_{100}^{153}$Fm只是元素镄的一个原子,153不代表镄元素的相对原子质量 | |
| D. | ${\;}_{112}^{277}$CnCn经过3次这样的衰变是得不到镄原子的,产生的是Cn的同位素原子 |
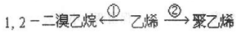
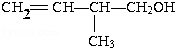
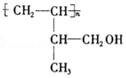 ;
;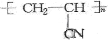 .
.
 ;
;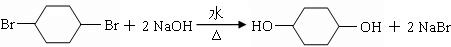 .
.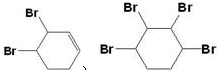 .
.