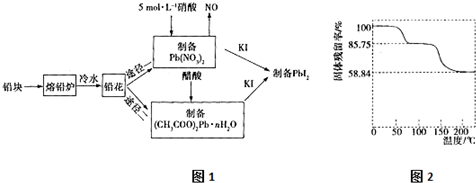
题目内容
1.在2L密闭恒容容器中,充入1mol N2和3mol H2,一定条件下发生合成氨反应,2min时达到平衡.测得平衡时N2的转化率为40%,求:(1)NH3的平衡浓度;
(2)该温度下的平衡常数K;
(3)H2在平衡混合气体中的体积分数;
(4)平衡时容器的压强与起始时压强之比.
分析 平衡时氮气的转化率为40%,据此可以计算出反应消耗的氮气的物质的量,然后利用化学平衡的三段式分别计算出起始、转化及平衡时各组分的物质的量,
(1)根据c=$\frac{n}{V}$计算出氨气的平衡浓度;
(2)分别计算出达到平衡时各组分的浓度,然后根据平衡常数的表达式计算出该反应的平衡常数;
(3)相同条件下气体的体积与物质的量成正比,据此计算出H2在平衡混合气体中的体积分数;
(4)相同条件下气体的压强与物质的量成正比,根据反应前后气体的物质的量计算出平衡时容器内的压强与起始时压强之比.
解答 解:平衡时氮气的转化率为40%,则反应达到平衡时消耗氮气的物质的量为:1mol×40%=0.4mol,
N2(g)+3H2(g)?2NH3(g)
起始(mol):1 3 0
转化(mol):0.4 1.2 0.8
平衡(mol):0.6 1.8 0.8
(1)NH3的平衡浓度为:c(NH3)=$\frac{0.8mol}{2L}$=0.4 mol∕L,
答:NH3的平衡浓度为:0.4 mol∕L;
(2)达到平衡时各组分浓度为:c(NH3)=$\frac{0.8mol}{2L}$=0.4 mol∕L、c(H2)=$\frac{1.8mol}{2L}$=0.9mol、c(N2)=$\frac{0.6mol}{2L}$=0.3mol/L,
则该反应的平衡常数为:K=$\frac{0.{4}^{2}}{0.{9}^{3}×0.3}$=0.73,
答:该温度下的平衡常数为0.73;
(3)相同条件下气体的体积之比等于其物质的量之比,则平衡时中H2体积分数为:$\frac{1.8mol}{1.8mol+0.6mol+0.8mol}$×100%=56.25%,
答:H2在平衡混合气体中的体积分数56.25%;
(4)相同条件下气体的压强之比等于物质的量之比,P后:P前=n后:n前=(1.8mol+0.6mol+0.8mol):4mol=4:5,
答:平衡时容器的压强与起始时压强之比为4:5.
点评 本题考查了化学平衡的有关计算,涉及平衡常数、转化率、体积分数的计算,题目难度中等,试题计算量较大、知识点较多,注意掌握化学平衡的三段式在计算中的应用方法.

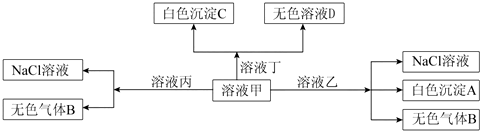
| A. | 溶液乙一定为AlCl3溶液 | |
| B. | 溶液丙与I-、NO3-、SO42-、K+一定可以大量共存 | |
| C. | 在甲中加丁可能发生反应的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| D. | 白色沉淀A可能溶解在溶液D中 |
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 2:3 |
| A. | 在一定条件下向容器中放入m molX和n mol Y,充分反应吸收Q kJ的能量 | |
| B. | 反应达到最大限度时,加入X,反应的△H增大 | |
| C. | 反应速率υ正(X)=$\frac{m}{n}$υ正(Y) | |
| D. | 降低温度,反应的速率值变大 |
| 元素 | I1/eV | I2/eV | I3/eV |
| 甲 | 5.7 | 47.4 | 71.8 |
| 乙 | 7.7 | 15.1 | 80.3 |
| 丙 | 13.0 | 23.9 | 40.0 |
| 丁 | 15.7 | 27.6 | 40.7 |
| A. | 甲的金属性比乙强 | B. | 乙的化合价为+1价 | ||
| C. | 丙一定为非金属元素 | D. | 丁一定是金属元素 |
 ,M中阴离子的离子符号为O22-.
,M中阴离子的离子符号为O22-.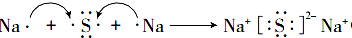 .
.