题目内容
10.某温度下已知反应mX(g)+nY(g)?qZ(g)△H=+Q kJ•mol-1(Q>0),下列叙述正确的是( )| A. | 在一定条件下向容器中放入m molX和n mol Y,充分反应吸收Q kJ的能量 | |
| B. | 反应达到最大限度时,加入X,反应的△H增大 | |
| C. | 反应速率υ正(X)=$\frac{m}{n}$υ正(Y) | |
| D. | 降低温度,反应的速率值变大 |
分析 A.放入m molX和n mol Y,不能完全转化;
B.△H与方程式有关;
C.反应速率之比等于化学计量数之比;
D.降温,反应速率减小.
解答 解:A.放入m molX和n mol Y,不能完全转化,则吸收的热量小于Q kJ,故A错误;
B.△H与方程式有关,则反应达到最大限度时,加入X,平衡正向移动,但反应的△H不变,故B错误;
C.反应速率之比等于化学计量数之比,则反应速率υ正(X)=$\frac{m}{n}$υ正(Y),故C正确;
D.降低温度,反应的速率值变小,故D错误;
故选C.
点评 本题考查化学平衡移动,为高频考点,把握平衡移动的限度、速率与化学计量数的关系、反应速率的影响因素为解答的关键,侧重分析与应用能力的考查,注意选项B为易错点,题目难度不大.

练习册系列答案
相关题目
15.常温下,下列各组离子在给定条件下一定能大量共存的是( )
| A. | c(H+)=1.0×10-12mol•L-1的溶液中:K+、AlO2-、NO3-、Na+ | |
| B. | pH=0的溶液:Fe2+、Br-、Na+、NO3- | |
| C. | 强酸性溶液中:Fe3+、K+、SCN-、SO42- | |
| D. | 石蕊试液呈紫色的溶液中:NH4+、Al3+、NO3-、HCO3- |
18.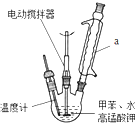 苯甲酸是一种化工原料,常用作制药和染料的中间体,也用于制取增塑剂和香料等.实验室合成苯甲酸的原理、有关数据及装置示意图如下:
苯甲酸是一种化工原料,常用作制药和染料的中间体,也用于制取增塑剂和香料等.实验室合成苯甲酸的原理、有关数据及装置示意图如下:
反应过程: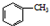 $→_{△}^{KMnO_{4}}$
$→_{△}^{KMnO_{4}}$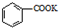 $\stackrel{HCl}{→}$
$\stackrel{HCl}{→}$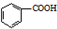
反应试剂、产物的物理常数:
注释:[1]100℃左右开始升华.
[2]苯甲酸在100g水中的溶解度为:4℃,0.18g;18℃,0.27g;75℃,2.2g.
按下列合成步骤回答问题:
Ⅰ.苯甲酸制备:
按如图在250mL三颈烧瓶中放入2.7mL甲苯和100mL水,控制100℃机械搅拌溶液,在石棉网上加热至沸腾.从冷
凝管上口分批加入8.5g高锰酸钾(加完后用少量水冲洗冷凝管内壁),继续搅拌约需4~5h,静置发现不再出
现分层现象时,停止反应.装置a的作用是将甲苯和水冷凝回流,防止甲苯的挥发而降低产品产率.写出并配平该反应化学方程式:

Ⅱ.分离提纯:
(1)除杂.将反应混合物加入一定量亚硫酸氢钠溶液使紫色褪去,此时反应的离子方程式为2MnO4-+3HSO3-+OH-=2MnO2↓+3SO42-+2 H2O.
(2)趁热过滤、热水洗涤.趁热过滤目的是除去二氧化锰并防止苯甲酸钾结晶析出造成损失.
(3)苯甲酸生成.合并实验(2)滤液和洗涤液,放在冰水浴中冷却,然后用浓盐酸酸化,至苯甲酸全部析出.将析出的苯甲酸减压过滤,得到滤液A和沉淀物B.沉淀物B用少量冷水洗涤,挤压去水分,把制得的苯甲酸放在水浴上干燥,得到粗产品C.
(4)粗产品提纯.将粗产品C进一步提纯,可用下列BD操作(填字母).
A.萃取分液 B.重结晶 C.蒸馏 D.升华
Ⅲ.产品纯度测定:称取1.220g产品,配成100mL乙醇溶液,移取25.00mL溶液于锥形瓶,滴加2~3滴酚酞(填写“甲基橙”或“酚酞”),然后用0.1000mol•L-1KOH溶液滴定,到达滴定终点时消耗KOH溶液24.00mL.产品中苯甲酸质量分数为96.00%.
 苯甲酸是一种化工原料,常用作制药和染料的中间体,也用于制取增塑剂和香料等.实验室合成苯甲酸的原理、有关数据及装置示意图如下:
苯甲酸是一种化工原料,常用作制药和染料的中间体,也用于制取增塑剂和香料等.实验室合成苯甲酸的原理、有关数据及装置示意图如下:反应过程:
 $→_{△}^{KMnO_{4}}$
$→_{△}^{KMnO_{4}}$ $\stackrel{HCl}{→}$
$\stackrel{HCl}{→}$
反应试剂、产物的物理常数:
| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解度(g) | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4[1] | 248 | 1.2659 | 微溶[2] | 易溶 |
[2]苯甲酸在100g水中的溶解度为:4℃,0.18g;18℃,0.27g;75℃,2.2g.
按下列合成步骤回答问题:
Ⅰ.苯甲酸制备:
按如图在250mL三颈烧瓶中放入2.7mL甲苯和100mL水,控制100℃机械搅拌溶液,在石棉网上加热至沸腾.从冷
凝管上口分批加入8.5g高锰酸钾(加完后用少量水冲洗冷凝管内壁),继续搅拌约需4~5h,静置发现不再出
现分层现象时,停止反应.装置a的作用是将甲苯和水冷凝回流,防止甲苯的挥发而降低产品产率.写出并配平该反应化学方程式:

Ⅱ.分离提纯:
(1)除杂.将反应混合物加入一定量亚硫酸氢钠溶液使紫色褪去,此时反应的离子方程式为2MnO4-+3HSO3-+OH-=2MnO2↓+3SO42-+2 H2O.
(2)趁热过滤、热水洗涤.趁热过滤目的是除去二氧化锰并防止苯甲酸钾结晶析出造成损失.
(3)苯甲酸生成.合并实验(2)滤液和洗涤液,放在冰水浴中冷却,然后用浓盐酸酸化,至苯甲酸全部析出.将析出的苯甲酸减压过滤,得到滤液A和沉淀物B.沉淀物B用少量冷水洗涤,挤压去水分,把制得的苯甲酸放在水浴上干燥,得到粗产品C.
(4)粗产品提纯.将粗产品C进一步提纯,可用下列BD操作(填字母).
A.萃取分液 B.重结晶 C.蒸馏 D.升华
Ⅲ.产品纯度测定:称取1.220g产品,配成100mL乙醇溶液,移取25.00mL溶液于锥形瓶,滴加2~3滴酚酞(填写“甲基橙”或“酚酞”),然后用0.1000mol•L-1KOH溶液滴定,到达滴定终点时消耗KOH溶液24.00mL.产品中苯甲酸质量分数为96.00%.
19.铝分别与足量的稀硫酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下的体积相等时,理论上反应中消耗的H2SO4和NaOH的物质的量之比是( )
| A. | 1:1 | B. | 1:2 | C. | 3:2 | D. | 3:1 |
20.下列说法不正确的是( )
| A. | 油脂属于酯类,在酸性或碱性条件下与水发生水解反应,称为皂化反应 | |
| B. | 淀粉、纤维素没有甜味,它们都是天然高分子化合物,在一定条件下水解都能生成葡萄糖 | |
| C. | 鸡蛋清的溶液中加入硫酸铜溶液,鸡蛋清凝聚,蛋白质变性 | |
| D. | 氨基酸分子中都含有-COOH和-NH2二种原子团,能相互反应形成更复杂的多肽化合物 |
 .
.