题目内容
6.随着经济的不断发展,人们对环境问题也越来越关注.(1)室内空气污染问题得到越来越多的关注,下列物质中也属于室内挥发性有机污染物的是a(填字母).
a.苯 b.甲烷 c.醋酸 d.甲醛
(2)下列措施中,有利于降低室内污染物浓度的是abcd(填字母).
a.勤开窗通风 b.日常生活中利用天然气替代煤作燃料
c.使用“绿色环保”装饰材料 d.室内放一些活性碳
(3)“温室效应”是全球关注的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决温室效应的有效途径,将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
a.6CO2+6H2O$\stackrel{光合作用}{→}$C6H12O6+6O2
b.CO2+3H2$\stackrel{催化剂}{→}$CH3OH+H2O
c.CO2+CH4$\stackrel{催化剂}{→}$CH3COOH
d.2CO2+6H2$\stackrel{催化剂}{→}$CH2═CH2+4H2O
以上反应中,最节能的是a,原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比)最高的是c.
(4)氟氯代烷(商品名氟利昂)曾被广泛用作制冷剂、灭火剂、溶剂等,因氯、溴的氟代烷对臭氧层产生破坏作用而被禁止、限制使用.
(5)“汽车尾气污染”已倍受世人关注.以辛烷(C8H18)代表汽油的成分,要使辛烷正好完全燃烧,则辛烷气与空气(空气中O2占1/5体积)的体积比(相同条件下)为0.016(保留三位小数).
分析 (1)甲烷、乙烯、醋酸不具有毒性,苯为有毒易挥发液体;
(2)a.勤开窗通风,能够使室内有毒气体排除;
b.日常生活中利用天然气替代煤作燃料,减少有毒物质的排放;
c.使用“绿色环保”装饰材料,减少有毒物质的排放;
d.室内放一些活性碳,能够吸附有毒物质;
(3)依据反应的条件和反应方程式特点解答;
(4)氟利昂进入大气层,能够消耗臭氧,破坏臭氧层;
(5)依据1molC8H18完全燃烧消耗12.5mol氧气结合空气中O2占$\frac{1}{5}$体积计算a值.
解答 解:(1)甲烷、乙烯、醋酸不具有毒性,苯为有毒易挥发液体,属于室内挥发性有机污染物,故选:a;
(2)a.勤开窗通风,能够使室内有毒气体排除;
b.日常生活中利用天然气替代煤作燃料,减少有毒物质的排放;
c.使用“绿色环保”装饰材料,减少有毒物质的排放;
d.室内放一些活性碳,能够吸附有毒物质;
都能起到降低室内污染物浓度,
故选:abcd;
(3)反应a在光合作用下进行,耗能最少,c中反应物原子全部转化为生成物,原子利用率最高;
故答案为:a;c;
(4)氟利昂进入大气层,能够消耗臭氧,破坏臭氧层;
故答案为:臭氧层;
(5)1molC8H18完全燃烧消耗12.5mol氧气,则1体积C8H18完全燃烧消耗12.5体积氧气,需要空气的体积为12.5×5=62.5,a=$\frac{1}{62.5}$=0.016,
故答案为:0.016.
点评 本题考查了环境的污染与防护,为高频考点,侧重于化学与环境、生活的考查,熟悉物臭氧空洞和臭氧层保护的知识及常见有机物的性质是解题关键,题目难度不大,注意对相关知识的积累.

练习册系列答案
相关题目
18.下列属于电解质的是( )
| A. | 盐酸 | B. | 蔗糖 | C. | 硫酸钠 | D. | 二氧化碳 |
15.常温下,下列各组离子在给定条件下一定能大量共存的是( )
| A. | c(H+)=1.0×10-12mol•L-1的溶液中:K+、AlO2-、NO3-、Na+ | |
| B. | pH=0的溶液:Fe2+、Br-、Na+、NO3- | |
| C. | 强酸性溶液中:Fe3+、K+、SCN-、SO42- | |
| D. | 石蕊试液呈紫色的溶液中:NH4+、Al3+、NO3-、HCO3- |
 由C与水反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.
由C与水反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑. 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视. 是一种具有较好耐热性、耐水性和高频电绝缘性的高分子化合物(树脂),它是由三种单体在一定条件下缩聚(同时还生成水)而成的.这三种单体分别是(写结构简式)C6H5NH2、HCHO和
是一种具有较好耐热性、耐水性和高频电绝缘性的高分子化合物(树脂),它是由三种单体在一定条件下缩聚(同时还生成水)而成的.这三种单体分别是(写结构简式)C6H5NH2、HCHO和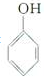 .它们的物质的量之比(按以上回答单体的顺序写)为1:2:1.
.它们的物质的量之比(按以上回答单体的顺序写)为1:2:1.