题目内容
7.A、B、C、D、E、F六种短周期主族元素的原子序数依次增大.A是元素周期表中原子半径最小的元素;B元素的原子最外层电子数是次外层电子数的2倍;D与A能形成两种原子个数比分别为1:1和1:2的共价化合物X和Y;D还能与E形成两种原子个数比分别为1:1和1:2的离子化合物M和N;F的最高正化合价为+6.回答下列问题:
(1)C元素的化学名称为氮,F元素的化学名称为硫.
(2)Y的电子式为
 ,M中阴离子的离子符号为O22-.
,M中阴离子的离子符号为O22-.(3)由以上六种元素中的两种原子构成的五核10e-分子的空间构型是正四面体.
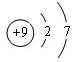
(4)用电子式表示化合物E2F的形成过程为
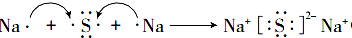 .
.(5)D、F的简单氢化物的沸点高低为H2O>H2S(用化学式表示).
分析 A、B、C、D、E、F六种短周期主族元素的原子序数依次增大,A是元素周期表中原子半径最小的元素,则A是H元素;B元素的原子最外层电子数是次外层电子数的2倍,最外层电子数不超过8个,第一周期元素最外层电子数不超过2个,则B是C元素;D与A能形成两种原子个数比分别为1:1和1:2的共价化合物X和Y,则D是O元素,X为H2O2、Y为H2O;C的原子序数大于B而小于D,为N元素;D还能与E形成两种原子个数比分别为1:1和1:2的离子化合物M和N,则E是Na元素,M、N分别是Na2O2、Na2O;F的最高正化合价为+6,且为短周期元素,为S元素,再结合题目分析解答.
解答 解:A、B、C、D、E、F六种短周期主族元素的原子序数依次增大,A是元素周期表中原子半径最小的元素,则A是H元素;
B元素的原子最外层电子数是次外层电子数的2倍,最外层电子数不超过8个,第一周期元素最外层电子数不超过2个,则B是C元素;
D与A能形成两种原子个数比分别为1:1和1:2的共价化合物X和Y,则D是O元素,X为H2O2、Y为H2O;
C的原子序数大于B而小于D,为N元素;
D还能与E形成两种原子个数比分别为1:1和1:2的离子化合物M和N,则E是Na元素,M、N分别是Na2O2、Na2O;
F的最高正化合价为+6,且为短周期元素,为S元素,
(1)C、F分别是N、S元素,其名称是氮、硫,故答案为:氮;硫;
(2)Y是水,其电子式为 ,M中阴离子是过氧根离子,离子符号为O22-,
,M中阴离子是过氧根离子,离子符号为O22-,
故答案为: ;O22-;
;O22-;
(3)由以上六种元素中的两种原子构成的五核10e-分子为CH4,甲烷分子的空间构型是正四面体,
故答案为:正四面体;
(4)E是Na、F是S元素,Na、S原子通过得失电子形成离子化合物硫化钠,形成过程为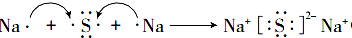 ,故答案为:
,故答案为: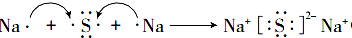 ;
;
(5)D、F的简单氢化物分别是水、硫化氢,水中含有氢键、硫化氢中不含氢键,含有氢键的氢化物熔沸点较高,所以D、F的简单氢化物的沸点高低为 H2O>H2S,
故答案为:H2O>H2S.
点评 本题考查位置结构性质相互关系及运用,为高频考点,侧重考查学生判断及综合知识运用能力,把握原子结构、元素周期表结构、物质结构、元素周期律是解本题关键,注意:氢键和分子间作用力影响分子晶体熔沸点,分子晶体熔沸点与化学键无关.

| A. | 盐酸 | B. | 蔗糖 | C. | 硫酸钠 | D. | 二氧化碳 |
| A. | c(H+)=1.0×10-12mol•L-1的溶液中:K+、AlO2-、NO3-、Na+ | |
| B. | pH=0的溶液:Fe2+、Br-、Na+、NO3- | |
| C. | 强酸性溶液中:Fe3+、K+、SCN-、SO42- | |
| D. | 石蕊试液呈紫色的溶液中:NH4+、Al3+、NO3-、HCO3- |
| A. | 用无水硫酸铜可检验酒精中是否有水 | |
| B. | 加生石灰进行过滤,可除去酒精中的水 | |
| C. | 用酒精可萃取出碘水中的碘 | |
| D. | 医院用100%酒精进行杀菌消毒 |
 由C与水反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.
由C与水反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.
 .
.