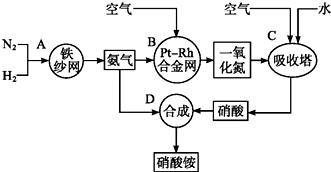
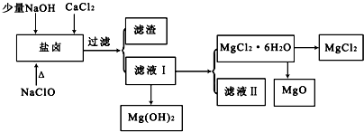
题目内容
6.已知25℃时,Ksp(FeS)=8.1×10-17,试求FeS的溶解度(要求有计算过程Fe-56,S-32).分析 设达到溶解平衡时c(Fe2+)为x,结合Ksp计算x,再结合$\frac{s}{100}$=$\frac{溶质质量}{溶剂质量}$计算.
解答 解:设达到溶解平衡时c(Fe2+)为x.
FeS(s)?Fe2+(aq)+S2-(aq)
x x
则x2=Ksp,x=$\sqrt{8.1×1{0}^{-17}}$=9×10-9 mol/L,
即1L溶液中含FeS的物质的量为9×10-9 mol,
S=$\frac{9×1{0}^{-9}mol×88g/mol}{1000g}$×100=7.92×10-8 g,
答:FeS的溶解度为7.92×10-8 g.
点评 本题考查难溶电解质的溶解度,为高频考点,把握Ksp及溶解度的计算为解答的关键,侧重分析与计算能力的考查,注意计算溶解度时溶剂质量近似为溶液的质量,题目难度不大.

练习册系列答案
相关题目
9.下列说法中正确的是( )
| A. | 1molH2约含有6.02×1023个微粒 | |
| B. | 1mol任何物质都约含有6.02×1023个分子 | |
| C. | 32gO2和O3的混合气体中约含1.204×1024个氧原子 | |
| D. | 1mol氖气中约含有1.204×1024个氖原子 |
18.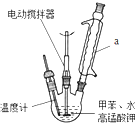 苯甲酸是一种化工原料,常用作制药和染料的中间体,也用于制取增塑剂和香料等.实验室合成苯甲酸的原理、有关数据及装置示意图如下:
苯甲酸是一种化工原料,常用作制药和染料的中间体,也用于制取增塑剂和香料等.实验室合成苯甲酸的原理、有关数据及装置示意图如下:
反应过程: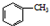 $→_{△}^{KMnO_{4}}$
$→_{△}^{KMnO_{4}}$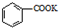 $\stackrel{HCl}{→}$
$\stackrel{HCl}{→}$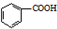
反应试剂、产物的物理常数:
注释:[1]100℃左右开始升华.
[2]苯甲酸在100g水中的溶解度为:4℃,0.18g;18℃,0.27g;75℃,2.2g.
按下列合成步骤回答问题:
Ⅰ.苯甲酸制备:
按如图在250mL三颈烧瓶中放入2.7mL甲苯和100mL水,控制100℃机械搅拌溶液,在石棉网上加热至沸腾.从冷
凝管上口分批加入8.5g高锰酸钾(加完后用少量水冲洗冷凝管内壁),继续搅拌约需4~5h,静置发现不再出
现分层现象时,停止反应.装置a的作用是将甲苯和水冷凝回流,防止甲苯的挥发而降低产品产率.写出并配平该反应化学方程式:

Ⅱ.分离提纯:
(1)除杂.将反应混合物加入一定量亚硫酸氢钠溶液使紫色褪去,此时反应的离子方程式为2MnO4-+3HSO3-+OH-=2MnO2↓+3SO42-+2 H2O.
(2)趁热过滤、热水洗涤.趁热过滤目的是除去二氧化锰并防止苯甲酸钾结晶析出造成损失.
(3)苯甲酸生成.合并实验(2)滤液和洗涤液,放在冰水浴中冷却,然后用浓盐酸酸化,至苯甲酸全部析出.将析出的苯甲酸减压过滤,得到滤液A和沉淀物B.沉淀物B用少量冷水洗涤,挤压去水分,把制得的苯甲酸放在水浴上干燥,得到粗产品C.
(4)粗产品提纯.将粗产品C进一步提纯,可用下列BD操作(填字母).
A.萃取分液 B.重结晶 C.蒸馏 D.升华
Ⅲ.产品纯度测定:称取1.220g产品,配成100mL乙醇溶液,移取25.00mL溶液于锥形瓶,滴加2~3滴酚酞(填写“甲基橙”或“酚酞”),然后用0.1000mol•L-1KOH溶液滴定,到达滴定终点时消耗KOH溶液24.00mL.产品中苯甲酸质量分数为96.00%.
 苯甲酸是一种化工原料,常用作制药和染料的中间体,也用于制取增塑剂和香料等.实验室合成苯甲酸的原理、有关数据及装置示意图如下:
苯甲酸是一种化工原料,常用作制药和染料的中间体,也用于制取增塑剂和香料等.实验室合成苯甲酸的原理、有关数据及装置示意图如下:反应过程:
 $→_{△}^{KMnO_{4}}$
$→_{△}^{KMnO_{4}}$ $\stackrel{HCl}{→}$
$\stackrel{HCl}{→}$
反应试剂、产物的物理常数:
| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解度(g) | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4[1] | 248 | 1.2659 | 微溶[2] | 易溶 |
[2]苯甲酸在100g水中的溶解度为:4℃,0.18g;18℃,0.27g;75℃,2.2g.
按下列合成步骤回答问题:
Ⅰ.苯甲酸制备:
按如图在250mL三颈烧瓶中放入2.7mL甲苯和100mL水,控制100℃机械搅拌溶液,在石棉网上加热至沸腾.从冷
凝管上口分批加入8.5g高锰酸钾(加完后用少量水冲洗冷凝管内壁),继续搅拌约需4~5h,静置发现不再出
现分层现象时,停止反应.装置a的作用是将甲苯和水冷凝回流,防止甲苯的挥发而降低产品产率.写出并配平该反应化学方程式:

Ⅱ.分离提纯:
(1)除杂.将反应混合物加入一定量亚硫酸氢钠溶液使紫色褪去,此时反应的离子方程式为2MnO4-+3HSO3-+OH-=2MnO2↓+3SO42-+2 H2O.
(2)趁热过滤、热水洗涤.趁热过滤目的是除去二氧化锰并防止苯甲酸钾结晶析出造成损失.
(3)苯甲酸生成.合并实验(2)滤液和洗涤液,放在冰水浴中冷却,然后用浓盐酸酸化,至苯甲酸全部析出.将析出的苯甲酸减压过滤,得到滤液A和沉淀物B.沉淀物B用少量冷水洗涤,挤压去水分,把制得的苯甲酸放在水浴上干燥,得到粗产品C.
(4)粗产品提纯.将粗产品C进一步提纯,可用下列BD操作(填字母).
A.萃取分液 B.重结晶 C.蒸馏 D.升华
Ⅲ.产品纯度测定:称取1.220g产品,配成100mL乙醇溶液,移取25.00mL溶液于锥形瓶,滴加2~3滴酚酞(填写“甲基橙”或“酚酞”),然后用0.1000mol•L-1KOH溶液滴定,到达滴定终点时消耗KOH溶液24.00mL.产品中苯甲酸质量分数为96.00%.
16.下表为元素周期表中的一部分,表中列出10种元素在周期表中的位置,
按要求回答下列问题.
(1)化学性质最不活泼的元素是氩(填名称).
(2)元素①的单质在氧气中燃烧,生成的氧化物的化学式是Na2O2,该化合物呈淡黄色.
(3)第3周期主族元素中,元素原子半径最小的是Cl(填元素符号).
(4)元素⑨的原子最外层电子数为5.
(5)元素⑤的氧化物常用于制造光导纤维(填一种高性能的现代通讯材料的名称).
(6)元素⑦、⑩中,化学性质较不活泼的元素是Br(填元素符号).
(7)元素④的氢化物化学式CH4,元素②的最高价氧化物对应的水化物的化学式Mg(OH)2.
(8)元素③的氢氧化物和稀盐酸反应的离子方程式Al(OH)3+3H+=Al3++3H2O.
按要求回答下列问题.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑥ | ||||||
| 3 | ① | ② | ③ | ⑤ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)元素①的单质在氧气中燃烧,生成的氧化物的化学式是Na2O2,该化合物呈淡黄色.
(3)第3周期主族元素中,元素原子半径最小的是Cl(填元素符号).
(4)元素⑨的原子最外层电子数为5.
(5)元素⑤的氧化物常用于制造光导纤维(填一种高性能的现代通讯材料的名称).
(6)元素⑦、⑩中,化学性质较不活泼的元素是Br(填元素符号).
(7)元素④的氢化物化学式CH4,元素②的最高价氧化物对应的水化物的化学式Mg(OH)2.
(8)元素③的氢氧化物和稀盐酸反应的离子方程式Al(OH)3+3H+=Al3++3H2O.
 是一种具有较好耐热性、耐水性和高频电绝缘性的高分子化合物(树脂),它是由三种单体在一定条件下缩聚(同时还生成水)而成的.这三种单体分别是(写结构简式)C6H5NH2、HCHO和
是一种具有较好耐热性、耐水性和高频电绝缘性的高分子化合物(树脂),它是由三种单体在一定条件下缩聚(同时还生成水)而成的.这三种单体分别是(写结构简式)C6H5NH2、HCHO和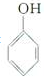 .它们的物质的量之比(按以上回答单体的顺序写)为1:2:1.
.它们的物质的量之比(按以上回答单体的顺序写)为1:2:1.