题目内容
20.乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔.(1)CaC2中C22+与O22+互为等电子体,O22+的电子式可表示为
 ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀.Cu+基态核外电子排布式为1s22s22p63s23p63d10.
(3)乙炔与氢氰酸反应可得丙烯腈(H2C═CH-C≡N).丙烯腈分子中碳原子轨道杂化类型有sp杂化 sp2杂化;分子中处于同一直线上的原子数目最多为3.
分析 (1)根据等电子体的结构相似,故O22+的电子式与C22-的电子式相似;根据三键中有2个π键来计算;
(2)根据Cu为29号元素,根据电子排布式的书写方法来解答;
(3)丙烯腈(H2C=CH-C≡N)中的C分别形成2个δ键和3个δ键,故碳原子的杂化轨道类型为sp和sp2杂化,以此判断杂化类型.
解答 解:(1)根据等电子体原理可知,O22+的电子式  ,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个π键,
,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个π键,
故答案为: ;2NA;
;2NA;
(2)Cu为29号元素,要注意3d轨道写在4s轨道的前面,同时还有就是它的3d结构,Cu+的基态电子排布式为1s22s22p63s23p63d10,
故答案为:1s22s22p63s23p63d10;
(3)H2C=CH-C≡N中,H2C=和=CH-中的C原子都形成3个δ键,碳原子的杂化轨道类型为sp和sp2杂化,同一直线上有3个原子,
故答案为:sp杂化,sp2杂化; 3.
点评 本题主要考查核外电子排布式、电子式的书写、杂化轨道类型判断、分子的平面构型,明确关物质的结构是解题关键,题目难度中等.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
10.热化学方程式C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol-1 表示的为( )
| A. | 碳与水反应吸收131.3 kJ的热量 | |
| B. | 1 mol碳和1 mol水反应吸收131.3 kJ的热量 | |
| C. | 1 mol固态碳与1 mol水蒸气反应产生一氧化碳气体和氢气,吸收131.3 kJ的热量 | |
| D. | 固态碳和气态水各1 mol反应,放出131.3 kJ的热量 |
11.下列说法正确的是( )
| A. | 被氧化的物质是氧化剂 | |
| B. | 失去电子,化合价降低的物质是还原剂 | |
| C. | 还原剂被还原,氧化剂被氧化 | |
| D. | 得到电子,化合价降低的反应物是氧化剂 |
8.A、B、C、D、E是元素周期表中前四周期常见元素,其原子序数依次增大.已知:
(1)常温下,某气态单质甲分子与AB分子互为等电子体,则一个甲分子中包含2个π键.
(2)关于B的氢化物,中心原子的杂化类型是sp3,分子的空间构型V形,其熔沸点比与它同主族的下一周期元素的氢化物的熔沸点高,原因是水分子间存在氢键.
(3)D元素原子核外有13种运动状态不同的电子.当C单质、D单质和NaOH溶液形成原电池时,该原电池的负极的电极反应式为:Al-3e-+4OH-=AlO2-+2H2O.
(4)E元素基态原子的价电子排布式1s22s22p63s23p63d104s1或[Ar]3d104s1.E晶体中微粒的堆积方式是面心立方最密堆积
| A | 单质在自然界中硬度最大 |
| B | 原子中s能级与p能级电子数相等且有单电子 |
| C | C在B的下一周期,C的电离能数据(kJ•mol-1)为:I1=738I2=1451I3=7732I4=10540 |
| D | 单质密度小,较好的延展性,广泛用于食品包装,D的氧化物是两性氧化物 |
| E | 单质是一种常见金属,与B元素能形成黑色和砖红色两种氧化物 |
(2)关于B的氢化物,中心原子的杂化类型是sp3,分子的空间构型V形,其熔沸点比与它同主族的下一周期元素的氢化物的熔沸点高,原因是水分子间存在氢键.
(3)D元素原子核外有13种运动状态不同的电子.当C单质、D单质和NaOH溶液形成原电池时,该原电池的负极的电极反应式为:Al-3e-+4OH-=AlO2-+2H2O.
(4)E元素基态原子的价电子排布式1s22s22p63s23p63d104s1或[Ar]3d104s1.E晶体中微粒的堆积方式是面心立方最密堆积
15.下列实验方案合理的是( )
| A. | 配制银氨溶液:在一定量氨水溶液中,滴加AgNO3至沉淀恰好溶解 | |
| B. | 配制Cu(OH)2悬浊液:在一定量CuSO4溶液中,加入少量NaOH溶液 | |
| C. | 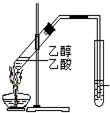 制备乙酸乙酯:用如图所示的实验装置 制备乙酸乙酯:用如图所示的实验装置 | |
| D. | 鉴别环己烯和苯:将溴的四氯化碳溶液分别滴加到少量环己烯和苯中 |
5.下列物质的分类中,前者是电解质,后者是非电解质的组合是( )
| A. | 空气、Cl2 | B. | NaHCO3、蔗糖 | C. | Ba(OH)2、CH3CH2OH | D. | H2SO4、盐酸 |
12.下列关于苯的结构和性质说法,正确的是( )
| A. | 苯是无色无味的液态径,不易燃烧 | |
| B. | 苯与浓硝酸、浓硫酸混合共热可制取硝基苯 | |
| C. | 溴水能与苯发生加成反应而褪色 | |
| D. | 在一定条件下苯与氢气反应制取环己烷,说明苯分子结构中有碳碳双键 |
9.在化学实验时必须注意安全操作,避免意外伤害,下列实验操作或事故处理中不正确的是( )
| A. | 在点燃易燃气体前,必须检验气体的纯度 | |
| B. | 在稀释浓硫酸时,应将浓硫酸用玻璃棒引流慢慢注入水中 | |
| C. | 浓硫酸有腐蚀性,沾到皮肤上,应用较多的水冲洗,再涂上碳酸氢钠稀溶液 | |
| D. | 不得点燃添满酒精的酒精灯 |