题目内容
8.A、B、C、D、E是元素周期表中前四周期常见元素,其原子序数依次增大.已知:| A | 单质在自然界中硬度最大 |
| B | 原子中s能级与p能级电子数相等且有单电子 |
| C | C在B的下一周期,C的电离能数据(kJ•mol-1)为:I1=738I2=1451I3=7732I4=10540 |
| D | 单质密度小,较好的延展性,广泛用于食品包装,D的氧化物是两性氧化物 |
| E | 单质是一种常见金属,与B元素能形成黑色和砖红色两种氧化物 |
(2)关于B的氢化物,中心原子的杂化类型是sp3,分子的空间构型V形,其熔沸点比与它同主族的下一周期元素的氢化物的熔沸点高,原因是水分子间存在氢键.
(3)D元素原子核外有13种运动状态不同的电子.当C单质、D单质和NaOH溶液形成原电池时,该原电池的负极的电极反应式为:Al-3e-+4OH-=AlO2-+2H2O.
(4)E元素基态原子的价电子排布式1s22s22p63s23p63d104s1或[Ar]3d104s1.E晶体中微粒的堆积方式是面心立方最密堆积
分析 A、B、C、D、E是元素周期表中前四周期常见元素,原子序数依次增大,A单质在自然界中硬度最大,则A为碳元素;
B原子中s能级与p能级电子数相等且有单电子,则B的核外电子排布为1s22s22p4,故B为N元素;
由C原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,且在B的下一周期,故C为Mg元素;
D单质密度小,较好的延展性,广泛用于食品包装,D的氧化物是两性氧化物,则D为Al元素;
E单质是一种常见金属,与O元素能形成黑色和砖红色两种氧化物,则E为Cu元素,据此解答.
解答 解:A、B、C、D、E是元素周期表中前四周期常见元素,原子序数依次增大,A单质在自然界中硬度最大,则A为碳元素;
B原子中s能级与p能级电子数相等且有单电子,则B的核外电子排布为1s22s22p4,故B为N元素;
由C原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,且在B的下一周期,故C为Mg元素;
D单质密度小,较好的延展性,广泛用于食品包装,D的氧化物是两性氧化物,则D为Al元素;
E单质是一种常见金属,与O元素能形成黑色和砖红色两种氧化物,则E为Cu元素,
(1)常温下,某气态单质甲分子与CO分子核外电子数相等,则甲为N2,分子中形成N≡N,一个氮气分子中包含2个π键;
故答案为:2;
(2)氮的氢化物,中心原子的杂化类型是sp3,分子的空间构型 V形,氨分子间存在氢键,其熔沸点比与它同主族的下一周期元素的氢化物的熔沸点高,故答案为:sp3;V形;水分子间存在氢键;
(3)铝元素原子核外有13个电子,所以有13种运动状态不同的电子,铝与氢氧化钠反应生成偏铝酸钠和氢气,该原电池的负极是铝发生氧化反应,生成偏铝酸根离子,其电极反应式为:Al-3e-+4OH-=AlO2-+2H2O,故答案为:13;Al-3e-+4OH-=AlO2-+2H2O;
(4)Cu是29号元素基态原子的价电子排布式1s22s22p63s23p63d104s1或[Ar]3d104s1,铜是面心立方最密堆积,故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;面心立方最密堆积.
点评 本题考查结构性质位置关系应用、核外电子排布规律、原电池、氢键等,难度中等,书写原电池负极电极反应,综合性强.

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案| A. | 向品红溶液中滴加亚硫酸 | |
| B. | KMnO4溶液滴定NaHSO3溶液,溶液由无色变为浅红色30s不褪色,即为滴定终点 | |
| C. | 久置氯水变成无色 | |
| D. | 向苯酚溶液中滴加FeCl3 |
| A. | v(N2)正=v(NH3)逆 | |
| B. | 单位时间内3 mol H-H发生断键反应,同时2 mol N-H发生也断键反应 | |
| C. | n(N2):n(H2):n(NH3)=1:3:2 | |
| D. | 反应混合物各组分的物质的量浓度不再改变 |
| A. | 溶液质量减轻 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 溶液中Cu2+与Fe2+的物质的量比为1:1 | |
| D. | 1 mol Fe可还原2 mol Fe3+ |
| A. | 原电池是将电能转化为化学能的装置 | |
| B. | 原电池中发生氧化反应的是负极 | |
| C. | 电解池是将化学能转化为电能的装置 | |
| D. | 电解池中发生氧化反应的是阴极 |
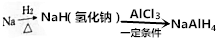 四氢铝钠(NaAlH4)在化工生产中有着重要应用.其简易合成工艺流程如图所示.
四氢铝钠(NaAlH4)在化工生产中有着重要应用.其简易合成工艺流程如图所示. ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA. 此烃名称为4-甲基-1-戊炔.
此烃名称为4-甲基-1-戊炔. 的烃可命名为1-甲基-3-乙基苯.
的烃可命名为1-甲基-3-乙基苯. 的烃可命名为:2,4-二甲基-3-乙基戊烷.
的烃可命名为:2,4-二甲基-3-乙基戊烷. 的键线式:
的键线式: .
. 的键线式:
的键线式: .
.