题目内容
11.下列说法正确的是( )| A. | 被氧化的物质是氧化剂 | |
| B. | 失去电子,化合价降低的物质是还原剂 | |
| C. | 还原剂被还原,氧化剂被氧化 | |
| D. | 得到电子,化合价降低的反应物是氧化剂 |
分析 氧化还原反应中,氧化剂得电子,被还原,生成还原产物,所含元素的化合价降低,还原剂失去电子被氧化,生成氧化产物,所含元素的化合价升高.
解答 解:A.被氧化的物质在反应中失去电子,是还原剂,故A错误;
B.失去电子、化合价升高的物质是还原剂,故B错误;
C.氧化剂具有氧化性,被还原,还原剂具有还原性,被氧化,故C错误;
D.氧化剂得到电子,化合价降低,故D正确.
故选D.
点评 本题考查氧化还原反应,为高考常见题型,注意把握元素化合价的变化与对应物质的性质,从化合价升降的角度认识氧化还原反应的相关概念,题目难道不大.

练习册系列答案
相关题目
19.甲醇(CH3OH)是一种有毒物质,检测甲醇含量的测试仪工作原理示意图如下.下列说法正确的是( )
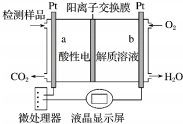

| A. | 溶液中H+从b向a定向移动 | |
| B. | a电极发生的电极反应为CH3OH-6e-+H2O=CO2↑+6H+ | |
| C. | 当电路中有1 mol e-转移时,正极区n(H+)增加1 mol | |
| D. | 将酸性电解质溶液改为碱性电解质溶液,该测试仪不可能产生电流 |
19.下列颜色变化不属于化学变化的是( )
| A. | 向品红溶液中滴加亚硫酸 | |
| B. | KMnO4溶液滴定NaHSO3溶液,溶液由无色变为浅红色30s不褪色,即为滴定终点 | |
| C. | 久置氯水变成无色 | |
| D. | 向苯酚溶液中滴加FeCl3 |
6. 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
(1)①写出工业合成氨的化学方程式N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
②由上表数据可知该反应为放热反应,理由是随温度升高,反应的平衡常数K减小.
③理论上,为了增大平衡时H2的转化率,可采取的措施是ad.(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
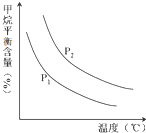
(2)原料气H2可通过反应 CH4(g)+H2O (g)═CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的 $\frac{n({H}_{2}O)}{n(C{H}_{4})}$ 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1<P2(填“>”、“=”或“<”).
②该反应为吸热反应(填“吸热”或“放热”).
(3)原料气H2还可通过反应CO(g)+H2O(g)═CO2 (g)+H2(g) 获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为60%,该反应平衡常数的表达式为2.25.
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填序号).
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO):n (H2O):n (CO2):n (H2)=1:1:1:1.
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
②由上表数据可知该反应为放热反应,理由是随温度升高,反应的平衡常数K减小.
③理论上,为了增大平衡时H2的转化率,可采取的措施是ad.(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g)+H2O (g)═CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的 $\frac{n({H}_{2}O)}{n(C{H}_{4})}$ 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1<P2(填“>”、“=”或“<”).
②该反应为吸热反应(填“吸热”或“放热”).
(3)原料气H2还可通过反应CO(g)+H2O(g)═CO2 (g)+H2(g) 获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为60%,该反应平衡常数的表达式为2.25.
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填序号).
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO):n (H2O):n (CO2):n (H2)=1:1:1:1.
16.在一个固定容积的密闭容器中,可逆反应N2+3H2$?_{高温高压}^{催化剂}$2NH3达到平衡的标志是( )
| A. | v(N2)正=v(NH3)逆 | |
| B. | 单位时间内3 mol H-H发生断键反应,同时2 mol N-H发生也断键反应 | |
| C. | n(N2):n(H2):n(NH3)=1:3:2 | |
| D. | 反应混合物各组分的物质的量浓度不再改变 |
3.含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol 的混合溶液中加入0.1mol铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+,同时析出0.1mol Ag,下列结论错误的是( )
| A. | 溶液质量减轻 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 溶液中Cu2+与Fe2+的物质的量比为1:1 | |
| D. | 1 mol Fe可还原2 mol Fe3+ |
 ;
;
 ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.