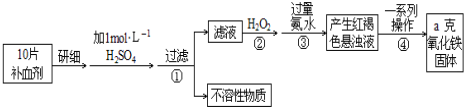
题目内容
15.下列实验方案合理的是( )| A. | 配制银氨溶液:在一定量氨水溶液中,滴加AgNO3至沉淀恰好溶解 | |
| B. | 配制Cu(OH)2悬浊液:在一定量CuSO4溶液中,加入少量NaOH溶液 | |
| C. | 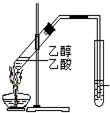 制备乙酸乙酯:用如图所示的实验装置 制备乙酸乙酯:用如图所示的实验装置 | |
| D. | 鉴别环己烯和苯:将溴的四氯化碳溶液分别滴加到少量环己烯和苯中 |
分析 A.配制银氨溶液时,应该将氨水加入硝酸银溶液;
B.配制Cu(OH)2悬浊液时,加入的氢氧化钠溶液必须过量;
C.收集乙酸乙酯的导管不能深入溶液中,否则会发生倒吸现象;
D.溴与苯乙烯反应,不与苯反应.
解答 解:A.配制银氨溶液时,正确操作方法为:在硝酸银溶液中滴加氨水至沉淀恰好消失,故A错误;
B.配制Cu(OH)2悬浊液,应该在一定量CuSO4溶液中加入过量的NaOH溶液,故B错误;
C.图示装置中收集乙酸乙酯的导管伸入饱和碳酸钠溶液中,会发生倒吸现象,该装置不合理,故C错误;
D.将溴的四氯化碳溶液分别滴加到少量环己烯和苯中,苯乙烯能够使溴的四氯化碳褪色,而苯不与溴反应,该方法可以鉴别苯乙烯和苯,故D正确;
故选D.
点评 本题考查了化学实验方案的评价,题目难度不大,明确常见化学实验基本操作方法为解答关键,注意掌握常见物质检验与鉴别方法,试题侧重考查学生的分析能力及化学实验能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.已知化学反应X+Y=M+N为吸热反应,下列说法正确的是( )
| A. | X的能量一定低于M的,Y的能量一定低于N的 | |
| B. | 因为该反应为吸热反应,所以一定要加热反应才能进行 | |
| C. | 断裂反应物中的化学键吸收的能量小于形成生成物中的化学键放出的能量 | |
| D. | 反应物X和Y的总能量一定小于生成物M和N的总能量 |
6. 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
(1)①写出工业合成氨的化学方程式N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
②由上表数据可知该反应为放热反应,理由是随温度升高,反应的平衡常数K减小.
③理论上,为了增大平衡时H2的转化率,可采取的措施是ad.(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
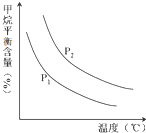
(2)原料气H2可通过反应 CH4(g)+H2O (g)═CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的 $\frac{n({H}_{2}O)}{n(C{H}_{4})}$ 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1<P2(填“>”、“=”或“<”).
②该反应为吸热反应(填“吸热”或“放热”).
(3)原料气H2还可通过反应CO(g)+H2O(g)═CO2 (g)+H2(g) 获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为60%,该反应平衡常数的表达式为2.25.
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填序号).
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO):n (H2O):n (CO2):n (H2)=1:1:1:1.
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
②由上表数据可知该反应为放热反应,理由是随温度升高,反应的平衡常数K减小.
③理论上,为了增大平衡时H2的转化率,可采取的措施是ad.(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g)+H2O (g)═CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的 $\frac{n({H}_{2}O)}{n(C{H}_{4})}$ 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1<P2(填“>”、“=”或“<”).
②该反应为吸热反应(填“吸热”或“放热”).
(3)原料气H2还可通过反应CO(g)+H2O(g)═CO2 (g)+H2(g) 获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为60%,该反应平衡常数的表达式为2.25.
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填序号).
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO):n (H2O):n (CO2):n (H2)=1:1:1:1.
3.含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol 的混合溶液中加入0.1mol铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+,同时析出0.1mol Ag,下列结论错误的是( )
| A. | 溶液质量减轻 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 溶液中Cu2+与Fe2+的物质的量比为1:1 | |
| D. | 1 mol Fe可还原2 mol Fe3+ |
7.下列说法中正确的一组是( )
| A. | H2和D2互为同位素 | B. |  和 和  互为同分异构体 互为同分异构体 | ||
| C. | 正丁烷和异丁烷是同系物 | D. |  和 和  是同一种物质 是同一种物质 |
4.部分果蔬中含有下列成分:
已知:
①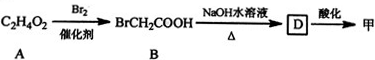
②1mol乙消耗NaHCO3 的物质的量是甲的2倍
③ $\stackrel{Fe,HCl}{→}$
$\stackrel{Fe,HCl}{→}$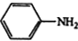 $→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$
$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$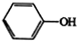
回答下列问题:
(1)甲可由已知①得到.
①甲中含有不饱和键的官能团名称为羧基.
②A→B为取代反应,A的结构简式为CH3COOH.
③B→D的化学方程式为BrCH2COOH+2NaOH$→_{△}^{H_{2}O}$HOCH2COONa+NaBr+H2O.
(2)乙在一定条件下生成链状酯类有机高分子化学物的化学方程式为n HOOCCH(OH)COOH$\stackrel{一定条件}{→}$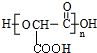 +(n-1)H2O.
+(n-1)H2O.
(3)由丙经下列途径可得一种重要的医药和香料中间体J(部分反应条件略去):
丙$→_{催化剂,△}^{H_{2}}$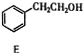 $\stackrel{经两步}{→}$
$\stackrel{经两步}{→}$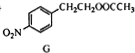 $→_{(2)H+,△}^{(1)Fe,HCl}$$\stackrel{{C}_{8}{H}_{11}NO}{H}$$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$J
$→_{(2)H+,△}^{(1)Fe,HCl}$$\stackrel{{C}_{8}{H}_{11}NO}{H}$$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$J
①用化学方法除去E中残留的少量丙(室温时E和丙呈液态,忽略它们在水中的溶解),第1步加入试剂的名称为新制氢氧化铜或银氨溶液,第2、3 步操作分别是过滤、分液.
②经E→G→H保护的官能团是羟基,可以表征有机化合物中存在何种官能团的仪器是红外光谱仪.
③J的同分异构体中在核磁共振氢谱上显示为两组峰,峰面积比为3:2的链状且不存在支链的异构体共有8种(不含立体异构),其中某异构体L中的官能团都能与H2 发生加成反应,则L的结构简式为CH3CH2COC≡CCOCH2CH3或CH3COCH2C≡CCH2COCH3(只写一种).
| 甲 | 乙 | 丙 |
| 柚子 | 黄瓜 | 脐橙 |
| HOCH2COOH | C3H4O5 | 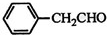 |
①
②1mol乙消耗NaHCO3 的物质的量是甲的2倍
③
 $\stackrel{Fe,HCl}{→}$
$\stackrel{Fe,HCl}{→}$ $→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$
$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$
回答下列问题:
(1)甲可由已知①得到.
①甲中含有不饱和键的官能团名称为羧基.
②A→B为取代反应,A的结构简式为CH3COOH.
③B→D的化学方程式为BrCH2COOH+2NaOH$→_{△}^{H_{2}O}$HOCH2COONa+NaBr+H2O.
(2)乙在一定条件下生成链状酯类有机高分子化学物的化学方程式为n HOOCCH(OH)COOH$\stackrel{一定条件}{→}$
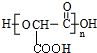 +(n-1)H2O.
+(n-1)H2O.(3)由丙经下列途径可得一种重要的医药和香料中间体J(部分反应条件略去):
丙$→_{催化剂,△}^{H_{2}}$
 $\stackrel{经两步}{→}$
$\stackrel{经两步}{→}$ $→_{(2)H+,△}^{(1)Fe,HCl}$$\stackrel{{C}_{8}{H}_{11}NO}{H}$$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$J
$→_{(2)H+,△}^{(1)Fe,HCl}$$\stackrel{{C}_{8}{H}_{11}NO}{H}$$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$J①用化学方法除去E中残留的少量丙(室温时E和丙呈液态,忽略它们在水中的溶解),第1步加入试剂的名称为新制氢氧化铜或银氨溶液,第2、3 步操作分别是过滤、分液.
②经E→G→H保护的官能团是羟基,可以表征有机化合物中存在何种官能团的仪器是红外光谱仪.
③J的同分异构体中在核磁共振氢谱上显示为两组峰,峰面积比为3:2的链状且不存在支链的异构体共有8种(不含立体异构),其中某异构体L中的官能团都能与H2 发生加成反应,则L的结构简式为CH3CH2COC≡CCOCH2CH3或CH3COCH2C≡CCH2COCH3(只写一种).
 ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.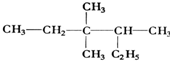 3,3,4-三甲基己烷
3,3,4-三甲基己烷 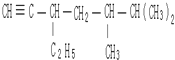 5,6-二甲基-3-乙基-1-庚炔
5,6-二甲基-3-乙基-1-庚炔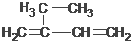 2-乙基-1,3-丁二烯
2-乙基-1,3-丁二烯 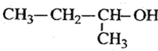 2-丁醇
2-丁醇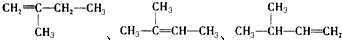 .
.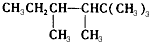 ,若A是单烯烃与氢气加成后的产物.则该单烯烃可能有5种结构.
,若A是单烯烃与氢气加成后的产物.则该单烯烃可能有5种结构.