题目内容
13.判断给定化学反应是否为氧化还原反应的依据是( )| A. | 看反应前后是否有氧原子的得失 | |
| B. | 看反应前后是否有原子的重新组合 | |
| C. | 看反应前后是否有元素的化合价发生改变 | |
| D. | 看反应后是否有气体生成 |
分析 氧化还原反应的特征为化合价变化,实质为电子转移,以此来解答.
解答 解:A.不一定有氧参加,故A不选;
B.原子数目在反应前后不变,故B不选;
C.含元素化合价变化的反应为氧化还原反应,则看反应前后是否有元素的化合价发生改变,故C选;
D.氧化还原反应中不一定有气体生成,故D不选;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的特征,题目难度不大.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
3.研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl.下列关于“水”电池的说法不正确的是( )
| A. | AgCl是还原产物 | |
| B. | 负极的电极反应为:Ag+Cl--e-═AgCl | |
| C. | Na+不断向“水”电池的正极移动 | |
| D. | 每生成1mol Na2Mn5O10转移2mol电子 |
8.a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种.已知(1)a、d、e均能与稀盐酸反应产生氢气;(2)b能从c的盐溶液中置换出c单质;(3)a与强碱溶液反应放出气体;(4)a、e在冷浓硝酸或浓硫酸中发生钝化.由此可判断a、b、c、d、e依次是( )
| A. | Fe、Cu、Ag、Al、Mg | B. | Mg、Cu、Al、Ag、Fe | C. | Al、Cu、Ag、Mg、Fe | D. | Mg、Ag、Cu、Al、Fe |
18.在100mL下列溶液中,分别加入0.05molNaOH固体,溶液的导电能力变化不大的是( )
| A. | 蒸馏水 | B. | 0.5 mol/L的醋酸溶液 | ||
| C. | 0.5 mol/L的盐酸 | D. | 0.5 mol/L的氨水 |
5. 利用如图1装置测定中和热的实验步骤如下:
利用如图1装置测定中和热的实验步骤如下:
①用量筒量取50mL0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol/LNaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.回答下列问题:
(1)仪器A的名称为环形玻璃搅拌棒.
(2)写成稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol)$\frac{1}{2}$H2SO4(l)+NaOH(l)=$\frac{1}{2}$Na2SO4(l)+H2O(l)△H=-57.3KJ/mol.
(3)倒入NaOH溶液的正确操作是C(填序号).
A.沿玻璃棒缓慢倒入B.分三次少量倒入C.一次迅速倒入
(4)使硫酸与NaOH溶液混合均匀的正确操作是E(从下列选出)D.
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(5)实验数据如下表:
①请填写下表中的空白:
②近似认为0.55mol/LNaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-56.8kJ/mol(取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(6)将V1mL1.0mol/LHCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图2所示(实验中始终保持V1+V2=50mL).则NaOH溶液的物质的量浓度为1.5 mol•L-1.
 利用如图1装置测定中和热的实验步骤如下:
利用如图1装置测定中和热的实验步骤如下:①用量筒量取50mL0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol/LNaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.回答下列问题:
(1)仪器A的名称为环形玻璃搅拌棒.
(2)写成稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol)$\frac{1}{2}$H2SO4(l)+NaOH(l)=$\frac{1}{2}$Na2SO4(l)+H2O(l)△H=-57.3KJ/mol.
(3)倒入NaOH溶液的正确操作是C(填序号).
A.沿玻璃棒缓慢倒入B.分三次少量倒入C.一次迅速倒入
(4)使硫酸与NaOH溶液混合均匀的正确操作是E(从下列选出)D.
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(5)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2℃ | 温度差平均值(t2-t1)℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(6)将V1mL1.0mol/LHCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图2所示(实验中始终保持V1+V2=50mL).则NaOH溶液的物质的量浓度为1.5 mol•L-1.
2.已知下述三个实验均能发生化学反应:
下列判断正确的是( )
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴氯水 | 将铜丝放入氯化铁溶液中 |
| A. | 实验①中铁钉只做还原剂 | |
| B. | 实验②中Fe2+既显氧化性又显还原性 | |
| C. | 实验③中发生的是置换反应 | |
| D. | 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ |
3.常温下,向20mL 0.2mol.L-1二元酸H2A溶液中滴加0.2mol.L-lNaOH溶液,有关微粒物质的量变化如图.下列叙述正确的是( )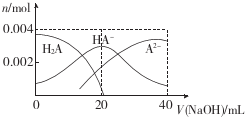

| A. | 当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为c(Na+)>c(HA-)>c( A2-)>c( OH-)>((H+) | |
| B. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水中的大 | |
| C. | 等浓度H2A和NaHA的混合溶液中无论加入少量的强酸或强碱,溶液的pH变化都不大 | |
| D. | 当V(NaOH)=40 mL时,升高温度,$\frac{c(N{a}^{+})}{c({A}^{2-})}$减小 |
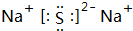 .
.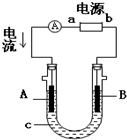 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题: