题目内容
4.W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素.(1)X的硝酸盐水溶液显酸性,用离子方程式解释原因Al3++3H2O?Al(OH)3+3H+.
(2)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl.
(4)W与Y可形成化合物W2Y,该化合物的电子式为
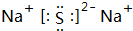 .
.(5)比较Y、Z气态氢化物的稳定性:H2S<HCl(用分子式表示).
(6)W、X、Y、Z四种元素简单离子的离子半径由小到大的顺序是:
Al3+<Na+<Cl-<S2-.
(7)Z的最高价氧化物为无色液体,0.5mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量.写出该反应的热化学方程式Cl2O7(l)+H2O(l)=2HClO4(aq)△H=-4QkJ/mol.
分析 W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,其最高价氧化物对应的水化物为碱,且两种碱可以反应生成盐和水,则W为Na元素,X为Al元素;Y、Z是非金属元素,W为Na,W可以和Y形成W2Y,则Y为-2价,为ⅥA元素,且和钠同周期,所以Y为S,Y的低价氧化物为SO2;Z原子序数比Y大,所以Y为Cl,据此解答.
解答 解:W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,其最高价氧化物对应的水化物为碱,且两种碱可以反应生成盐和水,则W为Na元素,X为Al元素;Y、Z是非金属元素,W为Na,W可以和Y形成W2Y,则Y为-2价,为ⅥA元素,且和钠同周期,所以Y为S,Y的低价氧化物为SO2;Z原子序数比Y大,所以Y为Cl.
(1)Y的硝酸盐为Al(NO3)3,由于Al3+的水解:Al3++3H2O?Al(OH)3+3H+,其溶液呈酸性,
故答案为:酸;Al3++3H2O?Al(OH)3+3H+;
(2)NaOH和Al(OH)3反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)Y的低价氧化物为SO2,并且Z和Y同周期,原子序数比Y大,所以Z为Cl,Y的低价氧化物和Z的单质反应方程式:SO2+Cl2+2H2O=H2SO4+2HCl,故答案为:SO2+Cl2+2H2O=H2SO4+2HCl;
(4)W2Y为Na2S,属于离子化合物,电子式为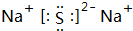 ,故答案为:
,故答案为: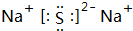 ;
;
(5)非金属性越强,气态氢化物的稳定性越强,由于非金属性:Cl>S,所以气态氢化物的稳定性:H2S<HCl,故答案为:H2S<HCl;
(6)核外电子排布相同的离子,核电荷数越大,离子半径越小,且离子核外电子层数越多,离子半径越大,则有离子半径Al3+<Na+<Cl-<S2-,
故答案为:Al3+<Na+<Cl-<S2-,
(7)Z的最高价氧化物为是Cl2O7,Cl2O7和水反应生成高氯酸,0.25molCl2O7和水反应放出QkJ热量,则1molCl2O7和水反应放出4QkJ热量,所以其热化学反应方程式为:Cl2O7(l)+H2O(l)=2HClO4(aq)△H=-4QkJ/mol,
故答案为:Cl2O7(l)+H2O(l)=2HClO4(aq)△H=-4QkJ/mol.
点评 本题考查结构性质位置关系应用,关键是对元素周期律的理解掌握,难度中等.

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
| A. | 原电池的总反应为Fe+Cu2+═Fe2++Cu | |
| B. | 盐桥中是KNO3溶液,则盐桥中NO3-移向乙烧杯 | |
| C. | 其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-═H2↑ | |
| D. | 反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过0.2mol电子 |
| A. | 看反应前后是否有氧原子的得失 | |
| B. | 看反应前后是否有原子的重新组合 | |
| C. | 看反应前后是否有元素的化合价发生改变 | |
| D. | 看反应后是否有气体生成 |
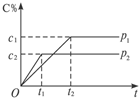 在一定温度下的可逆反应:mA(g)+nB(g)?pC(g)+qD(g),生成物C的体积分数与压强p1和p2,时间t1和t2的关系如图所示,则在下列关系中正确的是( )
在一定温度下的可逆反应:mA(g)+nB(g)?pC(g)+qD(g),生成物C的体积分数与压强p1和p2,时间t1和t2的关系如图所示,则在下列关系中正确的是( )| A. | p1>p2 | B. | 反应吸热 | C. | m+n>p+q | D. | m+n<p+q |
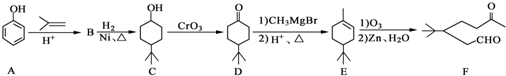
 .
. .同时满足下列条件的B的同分异构体(不包括B)共有11种:能与FeCl3溶液显紫色,苯环上只有两个取代基.
.同时满足下列条件的B的同分异构体(不包括B)共有11种:能与FeCl3溶液显紫色,苯环上只有两个取代基. (任写一种).
(任写一种).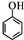 )和CH2=CH2为原料制备有机物
)和CH2=CH2为原料制备有机物  的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为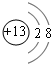 .
.